Ingeniería genética
Definición
Ingeniería genética , también llamada modificación genética o manipulación genética, es la manipulación directa de los genes de un organismo mediante la biotecnología. Es un conjunto de tecnologías utilizadas para cambiar la composición genética de las células, incluida la transferencia de genes dentro y a través de los límites de las especies para producir organismos mejorados o nuevos. El nuevo ADN se obtiene aislando y copiando el material genético de interés usando métodos de ADN recombinante o sintetizando artificialmente el ADN. Por lo general, se crea una construcción que se usa para insertar este ADN en el organismo huésped. La primera molécula de ADN recombinante fue fabricada por Paul Berg en 1972 combinando el ADN del virus del mono SV40 con el virus lambda. Además de insertar genes, el proceso puede usarse para eliminar genes o "eliminarlos". El nuevo ADN puede insertarse aleatoriamente o dirigirse a una parte específica del genoma.
Un organismo que se genera a través de la ingeniería genética se considera que está genéticamente modificado (GM) y la entidad resultante es un organismo genéticamente modificado (OGM). El primer OGM fue una bacteria generada por Herbert Boyer y Stanley Cohen en 1973. Rudolf Jaenisch creó el primer animal GM cuando insertó ADN extraño en un ratón en 1974. La primera compañía que se centró en la ingeniería genética, Genentech, se fundó en 1976 y comenzó la producción de proteínas humanas. La insulina humana genéticamente modificada se produjo en 1978 y las bacterias productoras de insulina se comercializaron en 1982. Los alimentos modificados genéticamente se han vendido desde 1994, con el lanzamiento del tomate Flavr Savr. El Flavr Savr fue diseñado para tener una vida útil más larga, pero la mayoría de los cultivos modificados genéticamente se modifican para aumentar la resistencia a los insectos y herbicidas. GloFish,
La ingeniería genética se ha aplicado en numerosos campos, incluidos la investigación, la medicina, la biotecnología industrial y la agricultura. En la investigación, los OGM se utilizan para estudiar la función y expresión génica a través de la pérdida de función, ganancia de función, seguimiento y experimentos de expresión. Al eliminar genes responsables de ciertas condiciones, es posible crear organismos modelo animales de enfermedades humanas. Además de producir hormonas, vacunas y otras drogas, la ingeniería genética tiene el potencial de curar enfermedades genéticas a través de la terapia genética. Las mismas técnicas que se utilizan para producir medicamentos también pueden tener aplicaciones industriales, como la producción de enzimas para detergentes para ropa, quesos y otros productos.
El aumento de los cultivos genéticamente modificados comercializados ha proporcionado beneficios económicos a los agricultores en muchos países diferentes, pero también ha sido la fuente de la mayoría de las controversias que rodean la tecnología. Esto ha estado presente desde su uso temprano, los primeros ensayos de campo fueron destruidos por activistas anti-GM. Aunque existe un consenso científico de que los alimentos actualmente disponibles derivados de cultivos transgénicos no representan un riesgo mayor para la salud humana que los alimentos convencionales, la seguridad alimentaria transgénica es una preocupación principal entre los críticos. El flujo genético, el impacto en organismos no objetivo, el control del suministro de alimentos y los derechos de propiedad intelectual también se han planteado como posibles problemas. Estas preocupaciones han llevado al desarrollo de un marco regulatorio, que comenzó en 1975. Ha llevado a un tratado internacional, el Protocolo de Cartagena sobre Bioseguridad, que fue adoptado en 2000.
Definición IUPAC
Ingeniería genética : Proceso de inserción de nueva información genética en las células existentes para modificar un organismo específico con el fin de cambiar sus características. Nota : Adaptado de la ref.
Visión de conjunto
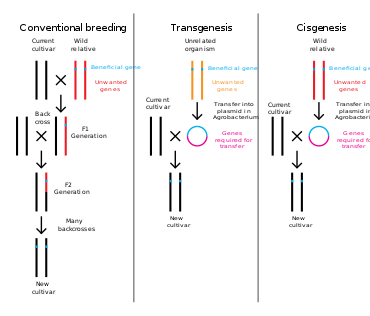
La ingeniería genética es un proceso que altera la estructura genética de un organismo eliminando o introduciendo ADN. A diferencia de la cría tradicional de animales y plantas, que implica hacer cruces múltiples y luego seleccionar el organismo con el fenotipo deseado, la ingeniería genética toma el gen directamente de un organismo y lo inserta en el otro. Esto es mucho más rápido, se puede usar para insertar cualquier gen de cualquier organismo (incluso de diferentes dominios) y evita que también se agreguen otros genes indeseables.
La ingeniería genética podría solucionar trastornos genéticos severos en humanos reemplazando el gen defectuoso por uno funcional. Es una herramienta importante en la investigación que permite estudiar la función de genes específicos. Drogas, vacunas y otros productos se han cosechado de organismos diseñados para producirlos. Se han desarrollado cultivos que ayudan a la seguridad alimentaria al aumentar el rendimiento, el valor nutricional y la tolerancia al estrés ambiental.
El ADN se puede introducir directamente en el organismo huésped o en una célula que luego se fusiona o hibrida con el huésped. Esto se basa en técnicas de ácido nucleico recombinante para formar nuevas combinaciones de material genético hereditario seguido por la incorporación de ese material, ya sea indirectamente a través de un sistema vectorial o directamente a través de microinyección, macroinyección o microencapsulación.
La ingeniería genética normalmente no incluye la reproducción tradicional, la fertilización in vitro, la inducción de poliploidías, mutagénesis y técnicas de fusión celular que no utilizan ácidos nucleicos recombinantes ni un organismo genéticamente modificado en el proceso. Sin embargo, algunas definiciones amplias de ingeniería genética incluyen la reproducción selectiva. La clonación y la investigación con células madre, aunque no se considera ingeniería genética, están estrechamente relacionadas y la ingeniería genética puede usarse dentro de ellas. La biología sintética es una disciplina emergente que lleva la ingeniería genética un paso más allá al introducir material artificialmente sintetizado en un organismo.
Las plantas, los animales o los microorganismos que han sido modificados mediante la ingeniería genética se denominan organismos genéticamente modificados u OGM. Si se agrega material genético de otra especie al huésped, el organismo resultante se denomina transgénico. Si se utiliza material genético de la misma especie o una especie que puede reproducirse de forma natural con el huésped, el organismo resultante se denomina cisgénico. Si la ingeniería genética se utiliza para eliminar material genético del organismo objetivo, el organismo resultante se denomina organismo knockout. En Europa, la modificación genética es sinónimo de ingeniería genética, mientras que en los Estados Unidos de América y Canadá la modificación genética también se puede utilizar para referirse a métodos de mejoramiento más convencionales.
Historia
Los seres humanos han alterado los genomas de las especies durante miles de años a través de la cría selectiva, o la selección artificial en contraste con la selección natural, y más recientemente a través de la mutagénesis. La ingeniería genética como la manipulación directa del ADN por los seres humanos fuera de la cría y las mutaciones solo ha existido desde la década de 1970. El término "ingeniería genética" fue acuñado por Jack Williamson en su novela de ciencia ficción Dragon's Island , publicada en 1951, un año antes de que Alfred Hershey y Martha Chase confirmaran el papel del ADN en la herencia, y dos años antes de que James Watson y Francis Crick mostraran que la molécula de ADN tiene una estructura de doble hélice, aunque el concepto general de manipulación genética directa fue explorado en forma rudimentaria en la historia de ciencia ficción de Stanley G. Weinbaum en 1936 Isla de Proteus .
En 1972, Paul Berg creó las primeras moléculas de ADN recombinante combinando el ADN del virus de mono SV40 con el del virus lambda. En 1973, Herbert Boyer y Stanley Cohen crearon el primer organismo transgénico insertando genes de resistencia a antibióticos en el plásmido de una bacteria Escherichia coli . Un año después, Rudolf Jaenisch creó un ratón transgénico introduciendo ADN extraño en su embrión, convirtiéndolo en el primer animal transgénico del mundo. Estos logros generaron inquietudes en la comunidad científica sobre los riesgos potenciales de la ingeniería genética, que se discutieron por primera vez en profundidad en la Conferencia de Asilomar en 1975. Una de las principales recomendaciones de esta reunión fue que la supervisión gubernamental de la investigación del ADN recombinante debería establecerse hasta la la tecnología se consideró segura.
En 1976 Genentech, la primera compañía de ingeniería genética, fue fundada por Herbert Boyer y Robert Swanson y un año más tarde la compañía produjo una proteína humana (somatostatina) en E. coli . Genentech anunció la producción de insulina humana modificada genéticamente en 1978. En 1980, la Corte Suprema de los Estados Unidos en el caso Diamond v. Chakrabarty dictaminó que la vida alterada genéticamente podría ser patentada. La insulina producida por bacterias fue aprobada para su lanzamiento por la Administración de Alimentos y Medicamentos (FDA) en 1982.
En 1983, una compañía biotecnológica, Advanced Genetic Sciences (AGS) solicitó la autorización del gobierno de los EE. UU. Para realizar pruebas de campo con la cepa de Pseudomonas syringae sin hielo para proteger los cultivos de las heladas, pero grupos ambientalistas y manifestantes postergaron las pruebas de campo durante cuatro años con desafíos legales. En 1987, la cepa de hielo de P. syringae se convirtió en el primer organismo genéticamente modificado (OGM) que se liberaba en el medio ambiente cuando se rociaba con un campo de fresas y un campo de patatas en California. Ambos campos de prueba fueron atacados por grupos de activistas la noche antes de que ocurrieran las pruebas: "El primer sitio de prueba del mundo atrajo la primera papelera del mundo".
Los primeros ensayos de campo de plantas genéticamente modificadas ocurrieron en Francia y los Estados Unidos en 1986, las plantas de tabaco fueron diseñadas para ser resistentes a los herbicidas. La República Popular de China fue el primer país en comercializar plantas transgénicas, introduciendo un tabaco resistente a virus en 1992. En 1994 Calgene logró la aprobación para comercializar el primer alimento genéticamente modificado, el Flavr Savr, un tomate diseñado para tener una vida útil más larga. . En 1994, la Unión Europea aprobó el tabaco diseñado para ser resistente al herbicida bromoxinilo, convirtiéndolo en el primer cultivo genéticamente modificado comercializado en Europa. En 1995, Bt Potato fue aprobado seguro por la Agencia de Protección Ambiental, después de haber sido aprobado por la FDA, convirtiéndose en el primer cultivo productor de plaguicidas aprobado en los Estados Unidos.
En 2010, los científicos del Instituto J. Craig Venter crearon el primer genoma sintético y lo insertaron en una célula bacteriana vacía. La bacteria resultante, llamada Mycoplasma laboratorium, podría replicar y producir proteínas. Cuatro años más tarde, esto fue llevado un paso más allá cuando se desarrolló una bacteria que replicaba un plásmido que contenía un único par de bases, creando el primer organismo diseñado para usar un alfabeto genético expandido. En 2012, Jennifer Doudna y Emmanuelle Charpentier colaboraron para desarrollar el sistema CRISPR / Cas9, una técnica que puede utilizarse para alterar fácil y específicamente el genoma de casi cualquier organismo.
Proceso
Crear un OMG es un proceso de varios pasos. Los ingenieros genéticos primero deben elegir qué gen desean insertar en el organismo. Esto es impulsado por lo que el objetivo es para el organismo resultante y se basa en investigaciones anteriores. Se pueden llevar a cabo cribados genéticos para determinar genes potenciales y pruebas adicionales que luego se utilizan para identificar a los mejores candidatos. El desarrollo de microarrays, transcriptomas y secuenciación del genoma ha hecho que sea mucho más fácil encontrar genes adecuados. La suerte también juega su parte; el gen ready-up listo fue descubierto después de que los científicos notaron que una bacteria florecía en presencia del herbicida.
Aislamiento de genes y clonación
El siguiente paso es aislar el gen candidato. La célula que contiene el gen se abre y el ADN se purifica. El gen se separa mediante el uso de enzimas de restricción para cortar el ADN en fragmentos o la reacción en cadena de la polimerasa (PCR) para amplificar el segmento del gen. Estos segmentos pueden luego extraerse mediante electroforesis en gel. Si el gen elegido o el genoma del organismo donante ha sido bien estudiado, puede que ya sea accesible desde una biblioteca genética. Si se conoce la secuencia de ADN, pero no hay copias del gen disponibles, también se puede sintetizar artificialmente. Una vez aislado, el gen se liga a un plásmido que luego se inserta en una bacteria. El plásmido se replica cuando las bacterias se dividen, asegurando que haya copias ilimitadas del gen disponibles.
Antes de que el gen se inserte en el organismo objetivo, debe combinarse con otros elementos genéticos. Estos incluyen un promotor y una región terminadora, que inician y finalizan la transcripción. Se agrega un gen marcador seleccionable, que en la mayoría de los casos confiere resistencia a los antibióticos, por lo que los investigadores pueden determinar fácilmente qué células se han transformado con éxito. El gen también se puede modificar en esta etapa para una mejor expresión o efectividad. Estas manipulaciones se llevan a cabo usando técnicas de ADN recombinante, tales como digestiones de restricción, ligaciones y clonación molecular.
Inserción de ADN en el genoma del huésped
Hay una serie de técnicas disponibles para insertar el gen en el genoma del huésped. Algunas bacterias pueden absorber naturalmente ADN extraño. Esta capacidad puede ser inducida en otras bacterias a través del estrés (por ejemplo, choque térmico o eléctrico), lo que aumenta la permeabilidad de la membrana celular al ADN; el ADN mejorado puede integrarse con el genoma o existir como ADN extracromosómico. El ADN generalmente se inserta en las células animales mediante microinyección, donde se puede inyectar a través de la envoltura nuclear de la célula directamente en el núcleo, o mediante el uso de vectores virales.
En las plantas, el ADN a menudo se inserta utilizando la recombinación mediada por Agrobacterium , aprovechando la secuencia de ADN-T de Agrobacterium que permite la inserción natural del material genético en las células de la planta. Otros métodos incluyen biolística, donde partículas de oro o tungsteno se recubren con ADN y luego se inyectan en células de plantas jóvenes, y electroporación, que implica el uso de un choque eléctrico para hacer que la membrana celular sea permeable al ADN del plásmido. Debido al daño causado a las células y al ADN, la eficiencia de transformación de las biolísticas y la electroporación es menor que la transformación agrobacteriana y la microinyección.
Como solo una célula se transforma con material genético, el organismo debe regenerarse a partir de esa única célula. En las plantas esto se logra mediante el uso de cultivo de tejidos. En los animales, es necesario asegurarse de que el ADN insertado esté presente en las células madre embrionarias. Las bacterias consisten en una sola célula y se reproducen clonalmente por lo que la regeneración no es necesaria. Los marcadores seleccionables se usan para diferenciar fácilmente las células transformadas de las no transformadas. Estos marcadores generalmente están presentes en el organismo transgénico, aunque se han desarrollado varias estrategias que pueden eliminar el marcador seleccionable de la planta transgénica madura.
Se realizan pruebas adicionales usando PCR, hibridación Southern y secuenciación de ADN para confirmar que un organismo contiene el nuevo gen. Estas pruebas también pueden confirmar la ubicación cromosómica y el número de copias del gen insertado. La presencia del gen no garantiza que se exprese en niveles apropiados en el tejido diana, por lo que también se usan métodos que buscan y miden los productos del gen (ARN y proteína). Estos incluyen hibridación Northern, RT-PCR cuantitativa, Western blot, inmunofluorescencia, ELISA y análisis fenotípico.
El nuevo material genético puede insertarse aleatoriamente en el genoma del huésped o dirigirse a una ubicación específica. La técnica de selección de genes utiliza la recombinación homóloga para realizar los cambios deseados a un gen endógeno específico. Esto tiende a ocurrir a una frecuencia relativamente baja en plantas y animales y generalmente requiere el uso de marcadores seleccionables. La frecuencia de selección de genes se puede mejorar en gran medida a través de la edición del genoma. La edición del genoma utiliza nucleasas modificadas artificialmente que crean rupturas bicatenarias específicas en lugares deseados en el genoma, y utilizan los mecanismos endógenos de la célula para reparar la ruptura inducida por los procesos naturales de recombinación homóloga y unión final no homóloga. Hay cuatro familias de nucleasas diseñadas: meganucleasas, nucleasas con dedos de zinc, nucleasas efectoras de tipo activador de la transcripción (TALEN), y el sistema de ARN guía Cas9 (adaptado de CRISPR). TALEN y CRISPR son los dos más comúnmente utilizados y cada uno tiene sus propias ventajas. TALEN tiene una mayor especificidad de destino, mientras que CRISPR es más fácil de diseñar y más eficiente. Además de mejorar la orientación genética, las nucleasas modificadas genéticamente pueden usarse para introducir mutaciones en genes endógenos que generan un gen inactivado.
Aplicaciones
La ingeniería genética tiene aplicaciones en medicina, investigación, industria y agricultura y se puede utilizar en una amplia gama de plantas, animales y microorganismos. Las bacterias, los primeros organismos genéticamente modificados, pueden tener insertado ADN plásmido que contiene nuevos genes que codifican medicamentos o enzimas que procesan los alimentos y otros sustratos. Las plantas han sido modificadas para la protección contra insectos, resistencia a herbicidas, resistencia a virus, nutrición mejorada, tolerancia a presiones ambientales y producción de vacunas comestibles. La mayoría de los OGM comercializados son plantas de cultivo resistentes a los insectos o herbicidas. Los animales genéticamente modificados se han utilizado para la investigación, modelos de animales y la producción de productos agrícolas o farmacéuticos. Los animales genéticamente modificados incluyen animales con genes noqueados, mayor susceptibilidad a la enfermedad,
Medicina
La ingeniería genética tiene muchas aplicaciones a la medicina que incluyen la fabricación de medicamentos, la creación de animales modelo que imitan las condiciones humanas y la terapia genética. Uno de los primeros usos de la ingeniería genética fue la producción masiva de insulina humana en bacterias. Esta aplicación ahora se ha aplicado a hormonas de crecimiento humano, hormonas estimulantes del folículo (para tratar la infertilidad), albúmina humana, anticuerpos monoclonales, factores antihemofílicos, vacunas y muchas otras drogas. Los hibridomas de ratón, células fusionadas para crear anticuerpos monoclonales, se han adaptado mediante ingeniería genética para crear anticuerpos monoclonales humanos. En 2017, la FDA aprobó la ingeniería genética de los receptores de antígenos quiméricos en las propias células T de un paciente como tratamiento para la leucemia linfoblástica aguda por cáncer.
La ingeniería genética también se usa para crear modelos animales de enfermedades humanas. Los ratones genéticamente modificados son el modelo animal genéticamente modificado más común. Se han utilizado para estudiar y modelar el cáncer (el oncomouse), la obesidad, las enfermedades cardíacas, la diabetes, la artritis, el abuso de sustancias, la ansiedad, el envejecimiento y la enfermedad de Parkinson. Las curas potenciales se pueden probar contra estos modelos de ratón. También se han criado cerdos genéticamente modificados con el objetivo de aumentar el éxito del trasplante de un cerdo a otro.
La terapia génica es la ingeniería genética de los humanos, generalmente reemplazando genes defectuosos por genes efectivos. La investigación clínica con terapia génica somática se ha llevado a cabo con varias enfermedades, incluida la SCID ligada a X, la leucemia linfocítica crónica (LLC) y la enfermedad de Parkinson. En 2012, Alipogene tiparvovec se convirtió en el primer tratamiento de terapia génica aprobado para uso clínico. En 2015, se utilizó un virus para insertar un gen saludable en las células de la piel de un niño que padece una rara enfermedad de la piel, epidermólisis ampollosa, para crecer y luego injertar piel sana en el 80 por ciento del cuerpo del niño afectado por el enfermedad. La terapia génica de línea germinal daría lugar a que cualquier cambio sea heredable, lo que ha despertado inquietudes dentro de la comunidad científica. En 2015, se utilizó CRISPR para editar el ADN de embriones humanos no viables, los principales científicos de las principales academias mundiales piden una moratoria sobre las ediciones heredadas del genoma humano. También existe la preocupación de que la tecnología se pueda utilizar no solo para el tratamiento, sino también para mejorar, modificar o alterar la apariencia, la adaptabilidad, la inteligencia, el carácter o el comportamiento de un ser humano. La distinción entre cura y mejora también puede ser difícil de establecer.
Los investigadores están alterando el genoma de los cerdos para inducir el crecimiento de los órganos humanos que se utilizarán en los trasplantes. Los científicos están creando "impulsos genéticos", cambiando los genomas de los mosquitos para que sean inmunes a la malaria y luego diseminen los mosquitos genéticamente alterados por toda la población de mosquitos con la esperanza de eliminar la enfermedad.
Investigación
La ingeniería genética es una herramienta importante para los científicos naturales. Los genes y otra información genética de una amplia gama de organismos se pueden insertar en las bacterias para su almacenamiento y modificación, creando bacterias genéticamente modificadas en el proceso. Las bacterias son baratas, fáciles de cultivar, clónicas, se multiplican rápidamente, son relativamente fáciles de transformar y pueden almacenarse a -80 ° C casi indefinidamente. Una vez que se ha aislado un gen, se puede almacenar dentro de las bacterias, lo que proporciona un suministro ilimitado para la investigación.
Los organismos están genéticamente diseñados para descubrir las funciones de ciertos genes. Este podría ser el efecto sobre el fenotipo del organismo, donde se expresa el gen o con qué otros genes interactúa. Estos experimentos generalmente implican pérdida de función, ganancia de función, seguimiento y expresión.
- Pérdida de experimentos de función, como en un experimento genético inactivado, en el que un organismo se modifica para que carezca de la actividad de uno o más genes. En un simple knockout, se ha alterado una copia del gen deseado para que no sea funcional. Las células madre embrionarias incorporan el gen alterado, que reemplaza la copia funcional ya presente. Estas células madre se inyectan en blastocistos, que se implantan en madres sustitutas. Esto le permite al experimentador analizar los defectos causados por esta mutación y determinar así el papel de genes particulares. Se usa con especial frecuencia en biología del desarrollo. Cuando esto se hace mediante la creación de una biblioteca de genes con mutaciones puntuales en cada posición en el área de interés, o incluso cada posición en el gen completo, esto se llama "mutagénesis de barrido". El método más simple, y el primero en ser usado, es "
- Ganancia de experimentos de función , la contraparte lógica de knockouts. A veces se realizan junto con experimentos de eliminación para establecer más finamente la función del gen deseado. El proceso es muy similar al de la ingeniería de knock-out, excepto que la construcción está diseñada para aumentar la función del gen, generalmente proporcionando copias adicionales del gen o induciendo la síntesis de la proteína con mayor frecuencia. La ganancia de la función se utiliza para determinar si una proteína es suficiente o no para una función, pero no siempre significa que sea necesaria, especialmente cuando se trata de una redundancia genética o funcional.
- Experimentos de seguimiento , que buscan obtener información sobre la localización e interacción de la proteína deseada. Una forma de hacerlo es reemplazar el gen de tipo salvaje con un gen de "fusión", que es una yuxtaposición del gen de tipo salvaje con un elemento informante como la proteína verde fluorescente (GFP) que permitirá la fácil visualización de los productos. de la modificación genética. Si bien esta es una técnica útil, la manipulación puede destruir la función del gen, creando efectos secundarios y posiblemente cuestionando los resultados del experimento. Actualmente se están desarrollando técnicas más sofisticadas que pueden rastrear productos proteínicos sin mitigar su función, como la adición de pequeñas secuencias que servirán como motivos vinculantes para los anticuerpos monoclonales.
- Los estudios de expresión apuntan a descubrir dónde y cuándo se producen proteínas específicas. En estos experimentos, la secuencia de ADN antes del ADN que codifica una proteína, conocida como promotor del gen, se reintroduce en un organismo con la región codificante de la proteína reemplazada por un gen informador como la GFP o una enzima que cataliza la producción de un colorante . Por lo tanto, se puede observar el momento y el lugar donde se produce una proteína particular. Los estudios de expresión se pueden llevar un paso más allá al alterar el promotor para encontrar qué piezas son cruciales para la expresión adecuada del gen y están realmente unidas por proteínas del factor de transcripción; este proceso se conoce como ataques de promotores.
Industrial
Los organismos pueden transformar sus células con un gen que codifica una proteína útil, como una enzima, para que sobreexpresen la proteína deseada. Entonces se pueden fabricar cantidades masivas de la proteína cultivando el organismo transformado en un equipo de biorreactor usando fermentación industrial, y luego purificando la proteína. Algunos genes no funcionan bien en las bacterias, por lo que también se pueden usar levaduras, células de insectos o células de mamíferos. Estas técnicas se utilizan para producir medicamentos como la insulina, la hormona del crecimiento humano y las vacunas, suplementos como el triptófano, ayuda en la producción de alimentos (quimosina en la fabricación de queso) y combustibles. Otras aplicaciones con bacterias modificadas genéticamente podrían implicar realizar tareas fuera de su ciclo natural, como producir biocombustibles, limpiar derrames de petróleo, carbono y otros desechos tóxicos y la detección de arsénico en el agua potable. Ciertos microbios genéticamente modificados también se pueden utilizar en biominería y biorremediación, debido a su capacidad de extraer metales pesados de su entorno e incorporarlos en compuestos que son más fácilmente recuperables.
En la ciencia de los materiales, un virus genéticamente modificado se ha utilizado en un laboratorio de investigación como andamio para ensamblar una batería de iones de litio más respetuosa con el medio ambiente. Las bacterias también han sido diseñadas para funcionar como sensores al expresar una proteína fluorescente bajo ciertas condiciones ambientales.
Agricultura
Una de las aplicaciones más conocidas y polémicas de la ingeniería genética es la creación y el uso de cultivos genéticamente modificados o de ganado genéticamente modificado para producir alimentos genéticamente modificados. Los cultivos se han desarrollado para aumentar la producción, aumentar la tolerancia al estrés abiótico, alterar la composición de los alimentos o producir productos novedosos.
Los primeros cultivos que se realizaron comercialmente a gran escala proporcionaron protección contra plagas de insectos o tolerancia a herbicidas. Los cultivos resistentes a hongos y virus también se han desarrollado o están en desarrollo. Esto facilita el manejo de insectos y malezas en los cultivos e indirectamente puede aumentar el rendimiento de los cultivos. También se están desarrollando cultivos transgénicos que mejoran directamente el rendimiento al acelerar el crecimiento o hacer que la planta sea más resistente (mejorando la tolerancia a la sal, el frío o la sequía). En 2016, el salmón se modificó genéticamente con hormonas de crecimiento para alcanzar el tamaño adulto normal mucho más rápido.
Se han desarrollado OGM que modifican la calidad del producto al aumentar el valor nutricional o al proporcionar cualidades o cantidades más útiles industrialmente. La papa Amflora produce una mezcla de almidones más industrialmente útil. La soja y la canola han sido genéticamente modificadas para producir aceites más saludables. El primer alimento GM comercializado fue un tomate que había retrasado la maduración, aumentando su vida útil.
Las plantas y los animales han sido diseñados para producir materiales que normalmente no producen. Pharming utiliza cultivos y animales como biorreactores para producir vacunas, productos intermedios de medicamentos o las propias drogas; el producto útil se purifica de la cosecha y luego se utiliza en el proceso estándar de producción farmacéutica. Las vacas y las cabras han sido diseñadas para expresar drogas y otras proteínas en su leche, y en 2009 la FDA aprobó un medicamento producido en leche de cabra.
Otras aplicaciones
La ingeniería genética tiene aplicaciones potenciales en la conservación y el manejo del área natural. La transferencia de genes a través de vectores virales se ha propuesto como un medio para controlar especies invasoras y para vacunar a la fauna amenazada de enfermedades. Se han sugerido árboles transgénicos como una forma de conferir resistencia a patógenos en poblaciones silvestres. Con los crecientes riesgos de mala adaptación en los organismos como resultado del cambio climático y otras perturbaciones, la adaptación facilitada a través del ajuste genético podría ser una solución para reducir los riesgos de extinción. Las aplicaciones de la ingeniería genética en la conservación son, en su mayoría, teóricas y aún no se han llevado a la práctica.
La ingeniería genética también se está utilizando para crear arte microbiano. Algunas bacterias han sido genéticamente modificadas para crear fotografías en blanco y negro. Artículos de novedad como claveles de color lavanda, rosas azules y peces brillantes también se han producido a través de la ingeniería genética.
Regulación
La regulación de la ingeniería genética se refiere a los enfoques adoptados por los gobiernos para evaluar y gestionar los riesgos asociados con el desarrollo y la liberación de OGM. El desarrollo de un marco regulatorio comenzó en 1975, en Asilomar, California. La reunión de Asilomar recomendó un conjunto de pautas voluntarias con respecto al uso de la tecnología recombinante. A medida que la tecnología mejoró, EE. UU. Estableció un comité en la Oficina de Ciencia y Tecnología, que asignó la aprobación reglamentaria de alimentos GM al USDA, la FDA y la EPA. El Protocolo de Cartagena sobre Bioseguridad, un tratado internacional que rige la transferencia, manejo y uso de OGM, fue adoptado el 29 de enero de 2000. Ciento cincuenta y siete países son miembros del Protocolo y muchos lo utilizan como un punto de referencia para su regulaciones propias
El estado legal y regulatorio de los alimentos modificados genéticamente varía según el país, con algunos países prohibiéndolos o restringiéndolos, y otros permitiéndolos con grados de regulación muy diferentes. Algunos países permiten la importación de alimentos modificados genéticamente con autorización, pero o bien no permiten su cultivo (Rusia, Noruega, Israel) o tienen disposiciones para el cultivo, a pesar de que aún no se producen productos modificados genéticamente (Japón, Corea del Sur). La mayoría de los países que no permiten el cultivo de OGM permiten la investigación. Algunas de las diferencias más marcadas que se producen entre los Estados Unidos y Europa. La política de EE. UU. Se centra en el producto (no en el proceso), solo analiza los riesgos científicos verificables y utiliza el concepto de equivalencia sustancial. La Unión Europea, por el contrario, posiblemente tenga las reglamentaciones más estrictas sobre OMG en el mundo. Todos los OGM, junto con los alimentos irradiados, se consideran "
| Estados Unidos | USDA, FDA y EPA | |
| Europa | Autoridad Europea de Seguridad Alimentaria | |
| Canadá | Health Canada y la Agencia Canadiense de Inspección de Alimentos | Productos regulados con características nuevas independientemente del método de origen |
| África | Mercado común para África oriental y meridional | La decisión final recae en cada país individual. |
| China | Oficina de Administración de Bioseguridad en Ingeniería Genética Agrícola | |
| India | Comité Institucional de Bioseguridad, Comité de Revisión del Comité de Aprobación de Ingeniería Genética y Manipulación Genética | |
| Argentina | Comité Asesor Nacional de Biotecnología Agrícola (impacto ambiental), el Servicio Nacional de Salud y Calidad Agroalimentaria (inocuidad de los alimentos) y la Dirección Nacional de Agronegocios (efecto sobre el comercio) | Decisión final tomada por la Secretaría de Agricultura, Ganadería, Pesca y Alimentación. |
| Brasil | Comisión Técnica Nacional de Bioseguridad (medio ambiente y seguridad alimentaria) y Consejo de Ministros (cuestiones comerciales y económicas) | |
| Australia | Oficina del Regulador de Tecnología Genética (supervisa todos los productos de GM), Administración de Productos Terapéuticos (medicamentos GM) y Food Standards Australia New Zealand (alimentos GM). | Los gobiernos estatales individuales pueden entonces evaluar el impacto de la liberación en los mercados y el comercio y aplicar más legislación para controlar los productos genéticamente modificados aprobados. |
Una de las cuestiones clave que afectan a los reguladores es si los productos GM deben etiquetarse. La Comisión Europea dice que el etiquetado y la rastreabilidad obligatorios son necesarios para permitir una elección informada, evitar posibles falsas publicidades y facilitar la retirada de productos si se descubren efectos adversos sobre la salud o el medio ambiente. La Asociación Médica Estadounidense y la Asociación Estadounidense para el Avance de la Ciencia dicen que la ausencia de evidencia científica de daño, incluso el etiquetado voluntario, es engañosa y falsamente alarmará a los consumidores. El etiquetado de productos OGM en el mercado es obligatorio en 64 países. El etiquetado puede ser obligatorio hasta un umbral de nivel de contenido GM (que varía según los países) o voluntario. En Canadá y los Estados Unidos, el etiquetado de alimentos GM es voluntario,
Controversia
Los críticos se han opuesto al uso de la ingeniería genética en varios campos, que incluyen preocupaciones éticas, ecológicas y económicas. Muchas de estas preocupaciones involucran cultivos transgénicos y si los alimentos producidos a partir de ellos son seguros y qué impacto tendrán en el medio ambiente. Estas controversias han llevado a litigios, disputas de comercio internacional y protestas, y a la regulación restrictiva de productos comerciales en algunos países.
Las acusaciones de que los científicos están "jugando a ser Dios" y otras cuestiones religiosas se han atribuido a la tecnología desde el principio. Otras cuestiones éticas planteadas incluyen la patente de la vida, el uso de los derechos de propiedad intelectual, el nivel de etiquetado de los productos, el control del suministro de alimentos y la objetividad del proceso regulador. Aunque se han planteado dudas, la mayoría de los estudios económicos han descubierto que los cultivos transgénicos en crecimiento son beneficiosos para los agricultores.
El flujo genético entre cultivos MG y plantas compatibles, junto con un mayor uso de herbicidas selectivos, puede aumentar el riesgo de que se desarrollen "supermalezas". Otras preocupaciones ambientales involucran impactos potenciales sobre organismos no objetivo, incluidos los microbios del suelo, y un aumento de las plagas de insectos secundarios y resistentes. Muchos de los impactos ambientales con respecto a los cultivos transgénicos pueden tardar muchos años en ser comprendidos, y también son evidentes en las prácticas agrícolas convencionales. Con la comercialización de peces genéticamente modificados, existen preocupaciones sobre cuáles serán las consecuencias ambientales si escapan.
Hay tres preocupaciones principales sobre la seguridad de los alimentos genéticamente modificados: si pueden provocar una reacción alérgica; si los genes podrían transferirse de la comida a las células humanas; y si los genes no aprobados para el consumo humano podrían cruzarse con otros cultivos. Existe un consenso científico de que los alimentos actualmente disponibles derivados de cultivos transgénicos no representan un riesgo mayor para la salud humana que los alimentos convencionales, pero que cada alimento MG debe probarse caso por caso antes de la introducción. Sin embargo, los miembros del público son mucho menos propensos que los científicos a percibir alimentos GM como seguros.