Batería eléctrica
Definición
 Varias celdas y baterías (arriba a la izquierda a abajo a la derecha): dos AA, una D, una batería de radio de mano, dos de 9 voltios (PP3), dos AAA, una C, una batería de videocámara, una batería de teléfono inalámbrico | |
| Tipo | Fuente de alimentación |
|---|---|
| Principio de funcionamiento | Reacciones electroquímicas, fuerza electromotriz |
| Primera producción | 1800s |
| Símbolo electrónico | |
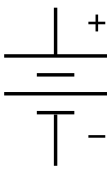 El símbolo de una batería en un diagrama de circuito. Se originó como un dibujo esquemático del primer tipo de batería, una pila voltaica. | |
Las baterías primarias (de un solo uso o "desechables") se usan una vez y se descartan; los materiales del electrodo se cambian irreversiblemente durante la descarga. Ejemplos comunes son la batería alcalina utilizada para linternas y una multitud de dispositivos electrónicos portátiles. Las baterías secundarias (recargables) se pueden descargar y recargar varias veces con una corriente eléctrica aplicada; la composición original de los electrodos se puede restaurar mediante corriente inversa. Los ejemplos incluyen las baterías de plomo-ácido usadas en los vehículos y las baterías de iones de litio que se usan para dispositivos electrónicos portátiles como computadoras portátiles y teléfonos inteligentes.
Las baterías vienen en muchas formas y tamaños, desde células miniatura utilizadas para alimentar audífonos y relojes de pulsera hasta células pequeñas y delgadas usadas en teléfonos inteligentes, baterías de plomo grandes usadas en automóviles y camiones, y en el extremo más grande, enormes bancos de baterías del tamaño de salas que ofrecen energía de reserva o de emergencia para centrales telefónicas y centros de datos informáticos.
Según una estimación de 2005, la industria mundial de la batería genera ventas por valor de US $ 48 mil millones cada año, con un crecimiento anual del 6%.
Las baterías tienen mucha menos energía específica (energía por unidad de masa) que los combustibles comunes como la gasolina. En los automóviles, esto se ve un tanto compensado por la mayor eficiencia de los motores eléctricos en la producción de trabajo mecánico, en comparación con los motores de combustión.
Historia
El uso de "batería" para describir un grupo de dispositivos eléctricos data de Benjamin Franklin, quien en 1748 describió múltiples frascos de Leyden por analogía a una batería de cañones (Benjamin Franklin tomó prestado el término "batería" de los militares, que se refiere al funcionamiento de las armas juntos).
El físico italiano Alessandro Volta construyó y describió la primera batería electroquímica, la pila voltaica, en 1800. Era una pila de placas de cobre y zinc, separadas por discos de papel empapados en salmuera, que podían producir una corriente constante durante un período de tiempo considerable. Volta no entendió que el voltaje se debía a reacciones químicas. Pensó que sus células eran una fuente inagotable de energía, y que los efectos de corrosión asociados en los electrodos eran una mera molestia, más que una consecuencia inevitable de su funcionamiento, como Michael Faraday mostró en 1834.
Aunque las baterías tempranas eran de gran valor para fines experimentales, en la práctica sus voltajes fluctuaban y no podían proporcionar una gran corriente durante un período sostenido. La celda Daniell, inventada en 1836 por el químico británico John Frederic Daniell, fue la primera fuente práctica de electricidad, convirtiéndose en un estándar de la industria y viendo una adopción generalizada como fuente de energía para redes de telégrafo eléctrico. Consistía en una olla de cobre llena de sulfato de cobre solución, en la que se sumergió un recipiente de loza sin esmaltar lleno de ácido sulfúrico y un electrodo de zinc.
Estas células húmedas usaban electrolitos líquidos, que eran propensos a fugas y derrames si no se manejaban correctamente. Muchos usaban frascos de vidrio para sostener sus componentes, lo que los hacía frágiles y potencialmente peligrosos. Estas características hacen que las celdas húmedas no sean aptas para dispositivos portátiles. Hacia fines del siglo XIX, la invención de las baterías de celdas secas, que sustituyeron el electrolito líquido por una pasta, hizo prácticos los dispositivos eléctricos portátiles.
Principio de funcionamiento
Las baterías convierten la energía química directamente en energía eléctrica. Una batería consiste en cierto número de celdas voltaicas. Cada célula consiste en dos medias celdas conectadas en serie por un electrolito conductor que contiene aniones y cationes. Una semicelda incluye electrolito y el electrodo negativo, el electrodo al que migran los aniones (iones con carga negativa); la otra semicelda incluye electrolito y el electrodo positivo al que migran los cationes (iones cargados positivamente). Las reacciones redox alimentan la batería. Los cationes se reducen (se agregan electrones) en el cátodo durante la carga, mientras que los aniones se oxidan (se eliminan los electrones) en el ánodo durante la carga. Durante la descarga, el proceso se revierte. Los electrodos no se tocan entre sí, sino que están conectados eléctricamente por el electrolito. Algunas células usan diferentes electrolitos para cada semicelda. Un separador permite que los iones fluyan entre las semiceldas, pero evita la mezcla de los electrolitos.
Cada semicelda tiene una fuerza electromotriz ( fem ), determinada por su capacidad para conducir la corriente eléctrica desde el interior hacia el exterior de la celda. La fem neta de la celda es la diferencia entre las fem de sus semiceldas. Por lo tanto, si los electrodos tienen emfs y , entonces, la fem neta es ; en otras palabras, la fem neta es la diferencia entre los potenciales de reducción de las semirreacciones.
La fuerza de accionamiento eléctrico o a través de los terminales de una celda se conoce como la tensión (diferencia) del terminal y se mide en voltios. El voltaje del terminal de una celda que no está cargando ni descargando se llama voltaje de circuito abierto y es igual a la fem de la celda. Debido a la resistencia interna, el voltaje del terminal de una celda que se está descargando es menor en magnitud que el voltaje de circuito abierto y el voltaje del terminal de una celda que está cargando excede el voltaje de circuito abierto. Una celda ideal tiene una resistencia interna despreciable, por lo que mantendría un voltaje de terminal constante de hasta agotado, luego cayendo a cero. Si dicha celda mantiene 1.5 voltios y almacena una carga de un culombio, luego de la descarga completa, realizará 1.5 julios de trabajo. En las celdas reales, la resistencia interna aumenta bajo descarga y el voltaje de circuito abierto también disminuye bajo descarga. Si el voltaje y la resistencia se grafican contra el tiempo, los gráficos resultantes son típicamente una curva; la forma de la curva varía según la química y la disposición interna empleada.
El voltaje desarrollado a través de los terminales de una celda depende de la liberación de energía de las reacciones químicas de sus electrodos y electrolitos. Las células alcalinas y de zinc-carbono tienen diferentes químicas, pero aproximadamente la misma fem de 1.5 voltios; asimismo, las células de NiCd y NiMH tienen diferentes químicas, pero aproximadamente la misma fem de 1.2 voltios. Los altos cambios de potencial electroquímico en las reacciones de los compuestos de litio dan emfs de células de litio de 3 voltios o más.
Categorías y tipos de baterías
Las baterías se clasifican en formas primarias y secundarias:
- Las baterías primarias están diseñadas para usarse hasta que se agote la energía y luego se descartan. Sus reacciones químicas generalmente no son reversibles, por lo que no se pueden recargar. Cuando se agota el suministro de reactivos en la batería, la batería deja de producir corriente y es inútil.
- Las baterías secundarias se pueden recargar; es decir, pueden tener sus reacciones químicas invertidas aplicando corriente eléctrica a la célula. Esto regenera los reactivos químicos originales, por lo que se pueden usar, recargar y volver a utilizar varias veces.
Algunos tipos de baterías primarias utilizadas, por ejemplo, para circuitos de telégrafo, se restauraron a la operación reemplazando los electrodos. Las baterías secundarias no se pueden recargar indefinidamente debido a la disipación de los materiales activos, la pérdida de electrolito y la corrosión interna.
Primario
Las baterías primarias, o células primarias, pueden producir corriente inmediatamente al ensamblar. Estos son los más comúnmente utilizados en dispositivos portátiles que tienen un bajo consumo de corriente, se usan solo de manera intermitente o se usan lejos de una fuente de alimentación alternativa, como en circuitos de alarma y comunicación donde otra energía eléctrica solo está disponible intermitentemente. Las células primarias desechables no se pueden recargar con fiabilidad, ya que las reacciones químicas no son fácilmente reversibles y los materiales activos pueden no volver a sus formas originales. Los fabricantes de baterías recomiendan no intentar recargar las celdas primarias. En general, tienen una mayor densidad de energía que las baterías recargables, pero las baterías desechables no funcionan bien en aplicaciones de alto consumo con cargas inferiores a 75 ohmios (75 Ω).
Secundario
Las baterías secundarias, también conocidas como celdas secundariaso baterías recargables , deben cargarse antes del primer uso; generalmente se ensamblan con materiales activos en estado descargado. Las baterías recargables se (re) cargan aplicando corriente eléctrica, lo que invierte las reacciones químicas que ocurren durante la descarga / uso. Los dispositivos para suministrar la corriente apropiada se llaman cargadores.
La forma más antigua de batería recargable es la batería de plomo-ácido, que se usa ampliamente en aplicaciones de automoción y navegación. Esta tecnología contiene electrolito líquido en un contenedor no sellado, lo que requiere que la batería se mantenga en posición vertical y que el área esté bien ventilada para garantizar la dispersión segura del gas de hidrógeno que produce durante la sobrecarga. La batería de plomo-ácido es relativamente pesada por la cantidad de energía eléctrica que puede suministrar. Su bajo costo de fabricación y sus altos niveles de sobrecorriente hacen que sea común donde su capacidad (más de aproximadamente 10 Ah) es más importante que los problemas de peso y manejo. Una aplicación común es la batería de automóvil moderna, que puede, en general, entregar una corriente máxima de 450 amperios.
La batería de plomo-ácido regulada por válvula sellada (batería VRLA) es popular en la industria automotriz como reemplazo de la celda húmeda de plomo-ácido. La batería VRLA usa un electrolito de ácido sulfúrico inmovilizado, lo que reduce la posibilidad de fugas y prolonga la vida útil. Las baterías VRLA inmovilizan el electrolito. Los dos tipos son:
- Las baterías de gel (o "celda de gel") usan un electrolito semisólido.
- Las baterías de esteras de vidrio absorbidas (AGM) absorben el electrolito en una estera especial de fibra de vidrio.
Otras baterías recargables portátiles incluyen varios tipos sellados de "pila seca", que son útiles en aplicaciones como teléfonos móviles y computadoras portátiles. Las celdas de este tipo (en orden de aumentar la densidad y el costo de potencia) incluyen níquel-cadmio (NiCd), níquel-zinc (NiZn), hidruro metálico de níquel (NiMH) e iones de litio (Li-ion). Li-ion tiene, con mucho, la mayor proporción del mercado de pilas secas recargables. NiMH ha reemplazado NiCd en la mayoría de las aplicaciones debido a su mayor capacidad, pero el NiCd permanece en uso en herramientas eléctricas, radios de dos vías y equipos médicos.
En la década de 2000, los desarrollos incluyen baterías con componentes electrónicos integrados como USBCELL, que permite cargar una batería AA a través de un conector USB, baterías nanoball que permiten una tasa de descarga de aproximadamente 100 veces mayor que las baterías actuales y paquetes de baterías inteligentes con monitores de estado y circuitos de protección de la batería que evitan daños por sobredescarga. Baja autodescarga (LSD) permite que las celdas secundarias se carguen antes del envío.
Tipos de células
Se han producido muchos tipos de celdas electroquímicas, con diferentes procesos y diseños químicos, que incluyen celdas galvánicas, celdas electrolíticas, celdas de combustible, celdas de flujo y pilas voltaicas.
Celda húmeda
Una batería de celda húmeda tiene un electrolito líquido. Otros nombres son células inundadas , ya que el líquido cubre todas las partes internas o la celda ventilada, ya que los gases producidos durante la operación pueden escapar al aire. Las células húmedas fueron un precursor de las células secas y se usan comúnmente como una herramienta de aprendizaje para la electroquímica. Se pueden construir con suministros de laboratorio comunes, como vasos de precipitados, para demostraciones de cómo funcionan las células electroquímicas. Un tipo particular de célula húmeda conocida como célula de concentración es importante para comprender la corrosión. Las células húmedas pueden ser células primarias (no recargables) o secundarias (recargables). Originalmente, todas las baterías primarias prácticas, como la celda Daniell, se construyeron como celdas húmedas de jarras de vidrio con tapa abierta. Otras células húmedas primarias son la célula de Leclanche, la célula de Grove, la célula de Bunsen, la célula de ácido crómico, la célula de Clark y la célula de Weston. La química de las células de Leclanche se adaptó a las primeras células secas. Las celdas húmedas aún se usan en baterías de automóviles y en la industria para energía de reserva para interruptores, telecomunicaciones o fuentes de alimentación ininterrumpida grandes, pero en muchos lugares se han utilizado baterías con celdas de gel. Estas aplicaciones comúnmente usan células de plomo-ácido o níquel-cadmio.
Pila seca
Una celda seca utiliza un electrolito en pasta, con solo la humedad suficiente para permitir el flujo de la corriente. A diferencia de una celda húmeda, una celda seca puede operar en cualquier orientación sin derramar, ya que no contiene líquido libre, por lo que es adecuado para equipos portátiles. En comparación, las primeras celdas húmedas eran típicamente contenedores de vidrio frágiles con barras de plomo que colgaban de la parte superior abierta y necesitaban una manipulación cuidadosa para evitar derrames. Las baterías de plomo no lograron la seguridad y la portabilidad de la celda seca hasta el desarrollo de la batería de gel.
Una pila seca común es la batería de zinc-carbono, a veces llamada pila seca Leclanché, con un voltaje nominal de 1.5 voltios, al igual que la batería alcalina (ya que ambos usan la misma combinación de dióxido de zinc y manganeso). Una celda seca estándar comprende un ánodo de zinc, generalmente en forma de una olla cilíndrica, con un cátodo de carbono en forma de una varilla central. El electrolito es cloruro de amonio en forma de una pasta junto al ánodo de zinc. El espacio restante entre el electrolito y el cátodo de carbono es absorbido por una segunda pasta que consiste en cloruro de amonio y dióxido de manganeso, este último actúa como un despolarizador. En algunos diseños, el cloruro de amonio se reemplaza por cloruro de zinc.
Sal fundida
Las baterías de sales fundidas son baterías primarias o secundarias que usan una sal fundida como electrolito. Operan a altas temperaturas y deben estar bien aislados para retener el calor.
reserva
Una batería de reserva se puede almacenar desarmada (sin activar y sin suministro de energía) durante un período prolongado (quizás años). Cuando se necesita la batería, entonces se ensambla (por ejemplo, agregando electrolito); una vez ensamblado, la batería está cargada y lista para funcionar. Por ejemplo, una batería para una espoleta de artillería electrónica podría activarse por el impacto de disparar una pistola. La aceleración rompe una cápsula de electrolito que activa la batería y alimenta los circuitos de la espoleta. Las baterías de reserva generalmente se diseñan para una vida útil corta (segundos o minutos) después de un almacenamiento prolongado (años). Una batería activada por agua para instrumentos oceanográficos o aplicaciones militares se activa al sumergirse en agua.
Rendimiento celular
Las características de una batería pueden variar durante el ciclo de carga, el ciclo de carga y la vida útil prolongada debido a muchos factores, como la química interna, el drenaje de corriente y la temperatura. A bajas temperaturas, una batería no puede entregar tanta potencia. Como tal, en climas fríos, algunos propietarios de automóviles instalan calentadores de batería, que son pequeñas almohadillas eléctricas que mantienen la batería del automóvil caliente.
Capacidad y descarga
La capacidad de una batería es la cantidad de carga eléctrica que puede entregar a la tensión nominal. Cuanto más material de electrodo contenga la célula, mayor será su capacidad. Una celda pequeña tiene menos capacidad que una celda más grande con la misma química, aunque desarrollan el mismo voltaje de circuito abierto. La capacidad se mide en unidades tales como amp-hour (A • h). La capacidad nominal de una batería generalmente se expresa como el producto de 20 horas multiplicado por la corriente que una batería nueva puede suministrar de forma consistente durante 20 horas a 68 ° F (20 ° C), mientras permanece por encima de un voltaje de terminal específico por celda. Por ejemplo, una batería con capacidad de 100 A • h puede entregar 5 A en un período de 20 horas a temperatura ambiente. La fracción de la carga almacenada que puede entregar una batería depende de múltiples factores, incluida la química de la batería, la velocidad a la que se entrega la carga (actual),
Cuanto mayor sea la velocidad de descarga, menor será la capacidad. La relación entre la corriente, el tiempo de descarga y la capacidad para una batería de plomo-ácido es aproximada (sobre un rango típico de valores actuales) según la ley de Peukert:
dónde
- es la capacidad cuando se descarga a una velocidad de 1 amperio.
- es la corriente extraída de la batería (A).
- es la cantidad de tiempo (en horas) que puede soportar una batería.
- es una constante alrededor de 1.3.
Las baterías que se almacenan durante un período prolongado o que se descargan en una pequeña fracción de la capacidad pierden capacidad debido a la presencia de reacciones secundariasgeneralmente irreversibles que consumen cargadores sin producir corriente. Este fenómeno se conoce como autodescarga interna. Además, cuando las baterías se recargan, pueden ocurrir reacciones secundarias adicionales, lo que reduce la capacidad para las descargas posteriores. Después de suficientes recargas, en esencia, se pierde toda la capacidad y la batería deja de producir energía.
Las pérdidas de energía internas y las limitaciones en la velocidad con la que los iones pasan a través del electrolito hacen que la eficiencia de la batería varíe. Por encima de un umbral mínimo, la descarga a una tasa baja proporciona una mayor capacidad de la batería que a una tasa mayor. La instalación de baterías con diferentes clasificaciones A • h no afecta el funcionamiento del dispositivo (aunque puede afectar el intervalo de funcionamiento) clasificado para un voltaje específico a menos que se excedan los límites de carga. Las cargas de alto consumo, como las cámaras digitales, pueden reducir la capacidad total, como ocurre con las pilas alcalinas. Por ejemplo, una batería con una capacidad de 2 A • h para una descarga de 10 o 20 horas no soportaría una corriente de 1 A durante dos horas completas, como lo implica su capacidad indicada.
Tasa de C
La tasa C es una medida de la velocidad a la que se carga o descarga una batería. Se define como la corriente a través de la batería dividida por el consumo de corriente teórico en virtud del cual la batería entregaría su capacidad nominal nominal en una hora. Una tasa de descarga de 1C entregaría la capacidad nominal de la batería en 1 hora. Una tasa de descarga de 2C significa que descargará el doble de rápido (30 minutos). Una tasa de descarga de 1C en una batería de 1.6 Ah significa una corriente de descarga de 1.6 A. Una tasa de 2C significaría una corriente de descarga de 3.2 A. Los estándares para baterías recargables generalmente califican la capacidad durante un tiempo de descarga de 4 horas, 8 horas o más. Debido a la pérdida de resistencia interna y los procesos químicos dentro de las celdas, una batería rara vez entrega la capacidad nominal de la placa de identificación en solo una hora. Tipos destinados a fines especiales,
La C-tasa presenta un error dimensional: C está en amperios-horas y no amperios, y uno no puede expresar una corriente en amperios-horas. Por este motivo el concepto que t se introdujo por el IEC61434 estándar internacional, I t ser igual a la capacidad C dividido por una hora, lo que permite a un método matemáticamente correcto de la designación actual. Las cifras utilizadas para expresar la velocidad de descarga siguen siendo las mismas: se puede hablar de "2 I t rate" en lugar de la "2 C rate" dimensionalmente incorrecta.
Carga rápida, baterías grandes y ligeras
A partir de 2012, la tecnología de la batería de fosfato de hierro y litio (
LiFePO 4
)
LiFePO 4
)
A partir de 2017, la batería más grande del mundo fue construida en el sur de Australia por Tesla. Puede almacenar 129 MWh. En 2013 se construyó una batería en la provincia de Hebei, China, que puede almacenar 36 MWh de electricidad a un costo de $ 500 millones. Otra batería grande, compuesta de células de Ni-Cd, estaba en Fairbanks, Alaska. Cubría 2.000 metros cuadrados (22.000 pies cuadrados), más grande que un campo de fútbol, y pesaba 1.300 toneladas. Fue fabricado por ABB para proporcionar energía de respaldo en caso de un apagón. La batería puede proporcionar 40 MW de potencia durante hasta siete minutos. Las baterías de azufre sódico se han utilizado para almacenar energía eólica. Un sistema de batería de 4.4 MWh que puede entregar 11 MW por 25 minutos estabiliza la producción del parque eólico Auwahi en Hawai.
Las baterías de litio-azufre se usaron en el vuelo solar más largo y más alto.
Toda la vida
La duración de la batería (y la duración de la batería sinónimo) tiene dos significados para las baterías recargables, pero solo una para las no recargables. Para recargables, puede significar tanto el período de tiempo que un dispositivo puede funcionar con una batería completamente cargada como la cantidad de ciclos de carga / descarga posible antes de que las celdas no funcionen satisfactoriamente. Para una no recargable, estas dos vidas son iguales ya que las celdas duran solo un ciclo por definición. (El término vida útil se usa para describir cuánto tiempo una batería retendrá su rendimiento entre fabricación y uso). La capacidad disponible de todas las baterías disminuye con la disminución de la temperatura. A diferencia de la mayoría de las baterías actuales, la pila Zamboni, inventada en 1812, ofrece una vida útil muy larga sin necesidad de reacondicionamiento o recarga, aunque solo suministra corriente en el rango de nanoamperios.
Autodescarga
Las baterías desechables generalmente pierden de un 8 a un 20 por ciento de su carga original por año cuando se almacenan a temperatura ambiente (20-30 ° C). Esto se conoce como la tasa de "autodescarga" y se debe a reacciones químicas "laterales" que no producen corriente y que ocurren dentro de la célula incluso cuando no se aplica carga. La tasa de reacciones secundarias se reduce para las baterías almacenadas a temperaturas más bajas, aunque algunas pueden dañarse por congelación.
Las baterías recargables viejas se autodescargan más rápidamente que las baterías alcalinas desechables, especialmente las baterías a base de níquel; una batería de níquel cadmio (NiCd) recién cargada pierde el 10% de su carga en las primeras 24 horas y luego descarga a una tasa de aproximadamente 10% por mes. Sin embargo, las baterías de hidruro metálico de níquel (NiMH) con autodescarga más baja y los diseños modernos de litio muestran una tasa de autodescarga más baja (pero aún más alta que para las baterías primarias).
Corrosión
Las partes internas pueden corroerse y fallar, o los materiales activos pueden convertirse lentamente a formas inactivas.
Cambios en el componente físico
El material activo en las placas de la batería cambia la composición química en cada ciclo de carga y descarga; el material activo puede perderse debido a cambios físicos de volumen, lo que limita aún más el número de veces que la batería puede recargarse. La mayoría de las baterías basadas en níquel se descargan parcialmente cuando se compran y deben cargarse antes del primer uso. Las baterías más nuevas de NiMH están listas para usarse cuando se compran y tienen solo un 15% de descarga en un año.
Se produce cierto deterioro en cada ciclo de carga y descarga. La degradación generalmente ocurre porque el electrolito migra lejos de los electrodos o porque el material activo se separa de los electrodos. Las baterías NiMH de baja capacidad (1,700-2,000 mA • h) se pueden cargar unas 1,000 veces, mientras que las baterías NiMH de alta capacidad (más de 2,500 mA • h) duran aproximadamente 500 ciclos. Las baterías de NiCd tienden a tener una capacidad de 1.000 ciclos antes de que su resistencia interna aumente permanentemente más allá de los valores utilizables.
Velocidad de carga / descarga
La carga rápida aumenta los cambios de los componentes, acortando la vida útil de la batería.
Sobrecarga
Si un cargador no puede detectar cuándo la batería está completamente cargada, es probable que se produzca una sobrecarga, dañándola.
Efecto de memoria
Las celdas de NiCd, si se usan de manera particular y repetitiva, pueden mostrar una disminución en la capacidad llamada "efecto de memoria". El efecto se puede evitar con prácticas simples. Las células NiMH, aunque son similares en química, sufren menos efecto memoria.
Condiciones ambientales
Las baterías recargables de plomo-ácido para automóviles deben soportar el estrés debido a la vibración, el impacto y el rango de temperatura. Debido a estas tensiones y la sulfatación de sus placas de plomo, pocas baterías de automóviles duran más de seis años de uso regular. Las baterías de arranque automotriz (SLI: Starting, Lighting, Ignition ) tienen muchas placas delgadas para maximizar la corriente. En general, cuanto más gruesas son las placas, más larga es la vida. Por lo general, se descargan solo ligeramente antes de la recarga.
Las baterías de plomo-ácido de "ciclo profundo", como las que se usan en los carritos de golf eléctricos, tienen placas mucho más gruesas para prolongar la vida útil. El principal beneficio de la batería de plomo-ácido es su bajo costo; sus principales inconvenientes son su gran tamaño y peso para una capacidad y voltaje dados. Las baterías de plomo nunca deben descargarse por debajo del 20% de su capacidad, porque la resistencia interna causará calor y daños cuando se recarguen. Los sistemas de plomo-ácido de ciclo profundo a menudo usan una luz de advertencia de carga baja o un interruptor de corte de baja carga para evitar el tipo de daño que acortará la vida útil de la batería.
Almacenamiento
La vida útil de la batería puede extenderse almacenando las baterías a baja temperatura, como en un refrigerador o congelador, lo que ralentiza las reacciones secundarias. Tal almacenamiento puede prolongar la vida de las baterías alcalinas en aproximadamente un 5%; Las baterías recargables pueden mantener su carga mucho más tiempo, dependiendo del tipo. Para alcanzar su voltaje máximo, las baterías deben devolverse a la temperatura ambiente; La descarga de una batería alcalina a 250 mA a 0 ° C es solo la mitad de eficaz que a 20 ° C. Los fabricantes de baterías alcalinas como Duracell no recomiendan las baterías de refrigeración.
Tamaños de batería
Las baterías primarias disponibles para los consumidores van desde diminutas células de botón utilizadas para relojes eléctricos hasta la celda Nº 6 utilizada para circuitos de señal u otras aplicaciones de larga duración. Las celdas secundarias están hechas en tamaños muy grandes; Las baterías muy grandes pueden alimentar un submarino o estabilizar una red eléctrica y ayudar a nivelar las cargas máximas.
Peligros
Explosión
La explosión de una batería generalmente se debe a un mal uso o mal funcionamiento, como el intento de recargar una batería primaria (no recargable) o un cortocircuito.
Cuando una batería se recarga a un ritmo excesivo, puede producirse una mezcla explosiva de gas de hidrógeno y oxígeno más rápidamente de lo que puede escapar de la batería (por ejemplo, a través de un respiradero incorporado), lo que lleva a la acumulación de presión y el estallido la caja de la batería. En casos extremos, los químicos de la batería pueden rociarse violentamente de la carcasa y causar lesiones. La sobrecarga, es decir, el intento de cargar una batería más allá de su capacidad eléctrica, también puede provocar una explosión de la batería, además de fugas o daños irreversibles. También puede causar daños al cargador o dispositivo en el que la batería sobrecargada se usa más adelante.
Es muy probable que las baterías del automóvil exploten cuando un cortocircuito genera corrientes muy grandes. Estas baterías producen hidrógeno, que es muy explosivo, cuando se sobrecargan (debido a la electrólisis del agua en el electrolito). Durante el uso normal, la cantidad de sobrecarga es generalmente muy pequeña y genera poco hidrógeno, que se disipa rápidamente. Sin embargo, cuando se "arranca" un automóvil, la corriente alta puede causar la liberación rápida de grandes volúmenes de hidrógeno, que pueden encenderse explosivamente con una chispa cercana, por ejemplo, al desconectar un cable de puente.
La eliminación de una batería mediante incineración puede causar una explosión a medida que se acumula vapor dentro de la caja sellada.
Los retiros de dispositivos que usan baterías de iones de litio se han vuelto más comunes en los últimos años. Esto es en respuesta a los accidentes y fallas reportados, ocasionalmente ignición o explosión. Un resumen experto del problema indica que este tipo utiliza "electrolitos líquidos para transportar iones de litio entre el ánodo y el cátodo. Si una batería se carga demasiado rápido, puede provocar un cortocircuito, lo que provoca explosiones e incendios".
Fuga
Muchos químicos de la batería son corrosivos, venenosos o ambos. Si se produce una fuga, ya sea espontáneamente o por accidente, los productos químicos liberados pueden ser peligrosos. Por ejemplo, las baterías desechables a menudo usan una "lata" de zinc como reactivo y como el contenedor para contener los otros reactivos. Si este tipo de batería está excesivamente descargada, los reactivos pueden emerger a través del cartón y plástico que forman el resto del contenedor. La fuga de químicos activos puede dañar o deshabilitar el equipo que alimentan las baterías. Por esta razón, muchos fabricantes de dispositivos electrónicos recomiendan retirar las baterías de los dispositivos que no se utilizarán durante largos períodos de tiempo.
Materiales tóxicos
Muchos tipos de baterías emplean materiales tóxicos como plomo, mercurio y cadmio como un electrodo o electrolito. Cuando cada batería llega al final de su vida útil, debe desecharse para evitar daños al medio ambiente. Las baterías son una forma de desechos electrónicos (e-waste). Los servicios de reciclaje de desechos electrónicos recuperan sustancias tóxicas, que luego pueden usarse para baterías nuevas. De los casi tres mil millones de baterías compradas anualmente en los Estados Unidos, alrededor de 179,000 toneladas terminan en vertederos en todo el país. En los Estados Unidos, la Ley de administración de baterías recargables y que contienen mercurio de 1996 prohibió la venta de baterías que contienen mercurio, estableció requisitos uniformes de etiquetado para las baterías recargables y exigió que las baterías recargables sean fácilmente extraíbles. California y la ciudad de Nueva York prohíben la eliminación de baterías recargables en desechos sólidos, y junto con Maine requieren el reciclaje de teléfonos celulares. La industria de la batería recargable opera programas de reciclaje a nivel nacional en los Estados Unidos y Canadá, con puntos de entrega en los minoristas locales.
La Directiva sobre baterías de la Unión Europea tiene requisitos similares, además de requerir un mayor reciclaje de baterías y promover la investigación sobre métodos mejorados de reciclaje de baterías. De acuerdo con esta directiva, todas las baterías que se vendan dentro de la UE deben estar marcadas con el "símbolo de recogida" (un contenedor con ruedas tachado). Esto debe cubrir al menos el 3% de la superficie de las baterías prismáticas y el 1,5% de la superficie de las baterías cilíndricas. Todos los envases deben estar marcados de la misma manera.
Ingestión
Las baterías pueden ser dañinas o fatales si se ingieren. Las células pequeñas de los botones pueden tragarse, en particular, por los niños pequeños. Mientras está en el tracto digestivo, la descarga eléctrica de la batería puede provocar daños en los tejidos; tal daño es ocasionalmente serio y puede llevar a la muerte. Las baterías de disco ingeridas generalmente no causan problemas a menos que se alojen en el tracto gastrointestinal. El lugar más común donde se alojan las baterías del disco es el esófago, lo que provoca secuelas clínicas. Es poco probable que las baterías que atraviesan con éxito el esófago se alojen en otro lugar. La probabilidad de que una batería de disco se aloje en el esófago es una función de la edad del paciente y del tamaño de la batería. Las baterías de disco de 16 mm se han alojado en el esófago de 2 niños menores de 1 año. Los niños mayores no tienen problemas con baterías de menos de 21-23 mm. La necrosis por licuefacción puede ocurrir porque el hidróxido de sodio es generado por la corriente producida por la batería (generalmente en el ánodo). La perforación se produjo tan rápido como 6 horas después de la ingestión.
Química
Muchas propiedades importantes de las celdas, como el voltaje, la densidad de energía, la inflamabilidad, las construcciones de celdas disponibles, el rango de temperatura de funcionamiento y la vida útil, están dictadas por la química de la batería.
Baterías primarias y sus características
| Química | Ánodo (-) | Cátodo (+) | Max.voltaje, teórico (V) | Tensión nominal, práctica (V) | Energía específica (MJ / kg) | Elaboración | Periodo de validez a 25 ° C, 80% de capacidad (meses) |
|---|---|---|---|---|---|---|---|
| Zinc-carbono | Zn | MnO2 | 1.6 | 1.2 | 0.13 | Barato. | 18 |
| Cloruro de zinc | 1.5 | También conocido como "heavy-duty", de bajo costo. | |||||
| Alcalino (dióxido de zinc-manganeso) | Zn | MnO2 | 1.5 | 1.15 | 0.4-0.59 | Densidad de energía moderada Bueno para usos de drenaje alto y bajo. | 30 |
| Oxihidróxido de níquel (dióxido de zinc-manganeso / oxihidróxido de níquel) | 1.7 | Densidad de energía moderada Bueno para altos usos de drenaje. | |||||
| Litio (óxido de litio y cobre) Li-CuO | Li | CuO | 1.7 | Ya no se fabrica. Reemplazado por baterías de óxido de plata (tipo IEC "SR"). | |||
| Litio (disulfuro de litio y hierro) LiFeS 2 | Li | FeS 2 | 1.8 | 1.5 | 1.07 | Costoso. Se usa en baterías 'plus' o 'extra'. | 337 |
| Litio (dióxido de litio y manganeso) LiMnO 2 | Li | MnO2 | 3.0 | 0.83-1.01 | Costoso. Se usa solo en dispositivos de alto consumo o para una larga vida útil debido a la baja tasa de autodescarga. 'Litio' solo generalmente se refiere a este tipo de química. | ||
| Litio (fluoruro de litio y carbono) Li- (CF) n | Li | (CF)n | 3.6 | 3.0 | 120 | ||
| Litio (óxido de litio-cromo) Li-CrO 2 | Li | CrO2 | 3.8 | 3.0 | 108 | ||
| Óxido de mercurio | Zn | HgO | 1.34 | 1.2 | Alto drenaje y voltaje constante. Prohibido en la mayoría de los países debido a problemas de salud. | 36 | |
| Zinc-aire | Zn | O2 | 1.6 | 1.1 | 1.59 | Se usa principalmente en audífonos. | |
| Pila de Zamboni | Zn | Ag o Au | 0.8 | Vida muy larga Muy baja (nanoamp, nA) actual | > 2,000 | ||
| Óxido de plata (plata-zinc) | Zn | Ag2O | 1.85 | 1.5 | 0.47 | Muy caro. Se usa solo comercialmente en celdas de 'botón'. | 30 |
| Magnesio | Mg | MnO2 | 2.0 | 1.5 | 40 |
Baterías secundarias (recargables) y sus características
| Química | Cellvoltage | Specificenergy (kJ / kg) | Densidad de energía (kJ / litro) | Comentarios |
|---|---|---|---|---|
| NiCd | 1.2 | 140 | Química de níquel-cadmio. Económica.Digado alto / bajo, densidad de energía moderada.Puede soportar tasas de descarga muy altas prácticamente sin pérdida de capacidad.Medida moderada de autodescarga. Peligro ambiental debido al cadmio: el uso ahora está prácticamente prohibido en Europa . | |
| Plomo-ácido | 2.1 | 140 | Moderadamente caro. Densidad de energía moderada. Tasa moderada de autodescarga. Las tasas de descarga más altas dan como resultado una pérdida considerable de capacidad. Peligro ambiental debido al plomo. Uso común: baterías de automóviles | |
| NiMH | 1.2 | 360 | Química de hidruro de níquel-metal. Económico. Funciona mejor que las baterías alcalinas en dispositivos de drenaje superiores. La química tradicional tiene una alta densidad de energía, pero también una alta tasa de autodescarga. La química más reciente tiene una baja tasa de autodescarga, pero también un ~ 25% menor densidad de energía. Usado en algunos autos. | |
| NiZn | 1.6 | 360 | Química de níquel-zinc. Menos costosa. Dispositivo de drenaje alto adecuado. Baja tasa de autodescarga. Voltaje más cercano a las células primarias alcalinas que otras células secundarias. Sin componentes tóxicos. Nueva presentación en el mercado (2009). Aún no ha establecido una trayectoria. Disponibilidad de tamaño limitada. | |
| AgZn | 1.861.5 | 460 | Química de plata y zinc. Volumen más pequeño que el equivalente de Li-ion. Extremadamente caro debido a la plata. Muy alta densidad de energía. Muy alta capacidad de drenaje. Durante muchos años se consideró obsoleto debido a los altos precios de la plata. La celda sufre oxidación si no se usa. Las reacciones no son completamente entendido.Terminal voltaje muy estable, pero de repente cae a 1,5 voltios a 70-80% de carga (cree que a la presencia de ambos Argentous y óxido de hierro en la placa positiva - uno se consume primero) .Se ha utilizado en lugar de la batería principal ( moon buggy). Se está desarrollando una vez más como un reemplazo para Li-ion. | |
| LiFePO 4 | 3.33.0 | 360 | 790 | Química de litio-hierro-fosfato. |
| Iones de litio | 3.6 | 460 | Varias químicas de litio.Muy cara.Densidad de energía muy alta.No suele estar disponible en tamaños de batería "comunes". La batería de polímero de litio es común en computadoras portátiles, cámaras digitales, videocámaras y teléfonos celulares. Muy baja tasa de autodescarga. El voltaje del terminal varía de 4.2 a 3.0 voltios durante la descarga. Válvula: posibilidad de explosión si se cortocircuita, se sobrecalienta o no se fabrica con rigurosos estándares de calidad. |
Baterías de estado sólido
El 28 de febrero de 2017, la Universidad de Texas en Austin emitió un comunicado de prensa sobre un nuevo tipo de batería de estado sólido, desarrollada por un equipo dirigido por el inventor de ion de litio (Li-Ion) John Goodenough, "que podría conducir a una mayor seguridad, baterías recargables de mayor duración y más duraderas para dispositivos móviles de mano, automóviles eléctricos y almacenamiento de energía estacionario ". Se publicaron más detalles sobre la nueva tecnología en la revista científica Energy & Environmental Science.
Las revisiones independientes de la tecnología discuten el riesgo de incendio y explosión de las baterías de iones de litio bajo ciertas condiciones porque usan electrolitos líquidos. La batería recién desarrollada debería ser más segura ya que usa electrolitos de vidrio, que deberían eliminar los cortocircuitos. También se dice que la batería de estado sólido tiene "tres veces la densidad de energía", lo que aumenta su vida útil en vehículos eléctricos, por ejemplo. También debería ser más ecológico, ya que la tecnología utiliza materiales menos costosos y amigables con el planeta, como el sodio extraído del agua de mar. También tienen una vida mucho más larga; ("las células han demostrado más de 1,200 ciclos con baja resistencia celular"). No se espera que la investigación y los prototipos conduzcan a un producto comercialmente viable en el futuro cercano, si es que alguna vez, de acuerdo con Chris Robinson de LUX Research. "Esto no tendrá un efecto tangible en la adopción de vehículos eléctricos en los próximos 15 años, si es que lo hace. Un obstáculo clave que enfrentan muchos electrólitos de estado sólido es la falta de un proceso de fabricación escalable y rentable", dijo a The American Energy News en un correo electrónico.
Células caseras
Casi cualquier objeto líquido o húmedo que tenga suficientes iones para ser eléctricamente conductores puede servir como electrolito para una célula. Como novedad o demostración científica, es posible insertar dos electrodos hechos de diferentes metales en un limón, patata, etc. y generar pequeñas cantidades de electricidad. Los "relojes de dos papas" también están ampliamente disponibles en tiendas de hobby y juguetes; consisten en un par de células, cada una de las cuales consiste en una papa (limón, etc.) con dos electrodos insertados en ella, conectados en serie para formar una batería con suficiente voltaje para alimentar un reloj digital. Las células caseras de este tipo no son uso práctico.
Una pila voltaica se puede hacer a partir de dos monedas (como un centavo y un centavo) y una toalla de papel humedecida en agua salada. Tal pila genera un voltaje muy bajo, pero, cuando muchos están apilados en serie, pueden reemplazar las baterías normales durante un corto período de tiempo.
Sony ha desarrollado una batería biológica que genera electricidad a partir del azúcar de una manera similar a los procesos observados en los organismos vivos. La batería genera electricidad mediante el uso de enzimas que descomponen los carbohidratos.
Las células de ácido de plomo pueden fabricarse fácilmente en casa, pero se necesita un tedioso ciclo de carga / descarga para "formar" las placas. Este es un proceso en el cual se forma sulfato de plomo en las placas, y durante la carga se convierte en dióxido de plomo (placa positiva) y plomo puro (placa negativa). La repetición de este proceso da como resultado una superficie microscópicamente rugosa, que aumenta el área de la superficie y aumenta la corriente que la célula puede suministrar.
Las células Daniell son fáciles de hacer en casa. Las baterías de aire y aluminio se pueden producir con aluminio de alta pureza. Las baterías de papel de aluminio producirán algo de electricidad, pero no son eficientes, en parte porque se produce una cantidad significativa de gas de hidrógeno (combustible).
Obtenido de: https://en.wikipedia.org/wiki/Electric_battery
















