Desintegración radioactiva
Definición
La desintegración radiactiva (también conocida como desintegración nuclear , radiactividad o radiación nuclear ) es el proceso por el cual un núcleo atómico inestable pierde energía (en términos de masa en su marco de descanso) emitiendo radiación, como una partícula alfa, una partícula beta con neutrino o solo un neutrino en el caso de la captura de electrones, o un rayo gamma o un electrón en el caso de una conversión interna. Un material que contiene tales núcleos inestables se considera radioactivo . Ciertos estados nucleares de vida corta altamente excitados pueden descomponerse a través de la emisión de neutrones, o más raramente, la emisión de protones.
La desintegración radiactiva es un proceso estocástico (es decir, aleatorio) a nivel de un único cuántico de átomos individuales, en el sentido de que, de acuerdo con la teoría cuántica, es imposible predecir cuándo decaerá un átomo en particular, independientemente de cuánto tiempo haya existido el átomo. Sin embargo, para una colección de átomos, la tasa de descomposición esperada de la colección se caracteriza en términos de sus constantes de decaimiento o semividas medidas. Esta es la base de la datación radiométrica. Las vidas medias de los átomos radiactivos no tienen un límite superior conocido, que abarca un rango de tiempo de más de 55 órdenes de magnitud, desde casi instantáneo hasta mucho más largo que la edad del universo.
Un núcleo radiactivo con giro cero no puede tener una orientación definida y, por lo tanto, emite el impulso total de sus productos de desintegración isotrópicamente (todas las direcciones y sin sesgo). Si hay múltiples partículas producidas durante una sola descomposición, como en la desintegración beta, su distribución angular relativa o las direcciones de giro pueden no ser isotrópicas. Los productos de descomposición de un núcleo con espín pueden distribuirse de forma no isótropa con respecto a esa dirección de espín, ya sea debido a una influencia externa tal como un campo electromagnético, o porque el núcleo se produjo en un proceso dinámico que restringió la dirección de su espín. Tal proceso parental podría ser una decadencia previa, o una reacción nuclear.
El núcleo en descomposición recibe el nombre de radionúclido principal (o radioisótopo parental) y el proceso produce al menos un nucleido hijo . Excepto por la desintegración gamma o la conversión interna de un estado de excitación nuclear, la desintegración es una transmutación nuclear que da como resultado una hija que contiene un número diferente de protones o neutrones (o ambos). Cuando la cantidad de protones cambia, se crea un átomo de un elemento químico diferente.
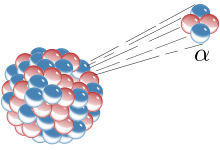
Los primeros procesos de desintegración que se descubrieron fueron la desintegración alfa, la desintegración beta y la desintegración gamma. La desintegración alfa ocurre cuando el núcleo eyecta una partícula alfa (núcleo de helio). Este es el proceso más común de emisión de nucleones, pero los núcleos altamente excitados pueden expulsar nucleones individuales, o en el caso de la descomposición del clúster, núcleos ligeros específicos de otros elementos. La descomposición beta ocurre de dos maneras: (i) decaimiento beta-menos, cuando el núcleo emite un electrón y un antineutrino en un proceso que cambia un neutrón a un protón, o (ii) decaimiento beta-plus, cuando el núcleo emite un positrón y un neutrino en un proceso que cambia un protón a un neutrón. Los núcleos altamente excitados ricos en neutrones, formados como el producto de otros tipos de descomposición, ocasionalmente pierden energía por la emisión de neutrones, lo que resulta en un cambio de un isótopo a otro del mismo elemento. El núcleo puede capturar un electrón en órbita, lo que hace que un protón se convierta en un neutrón en un proceso llamado captura de electrones. Todos estos procesos dan como resultado una transmutación nuclear bien definida.
Por el contrario, hay procesos de desintegración radiactiva que no resultan en una transmutación nuclear. La energía de un núcleo excitado puede emitirse como un rayo gamma en un proceso llamado desintegración gamma, o esa energía puede perderse cuando el núcleo interactúa con un electrón orbital que causa su eyección del átomo, en un proceso llamado conversión interna.
Otro tipo de desintegración radioactiva da como resultado productos que varían, que aparecen como dos o más "fragmentos" del núcleo original con un rango de masas posibles. Esta descomposición, llamada fisión espontánea, ocurre cuando un gran núcleo inestable se divide espontáneamente en dos (o en ocasiones tres) núcleos secundarios más pequeños, y generalmente conduce a la emisión de rayos gamma, neutrones u otras partículas de esos productos.
Para una tabla resumen que muestra el número de nucleidos estables y radiactivos en cada categoría, ver radionúclidos. Hay 28 elementos químicos naturales en la Tierra que son radiactivos, que consta de 33 radionucleidos (5 elementos tienen 2 radionucleidos diferentes) que datan del tiempo de la formación del sistema solar. Estos 33 se conocen como núclidos primordiales. Los ejemplos bien conocidos son el uranio y el torio, pero también se incluyen los radioisótopos de larga duración que se producen de forma natural, como el potasio-40. Otros 50 radionucleidos de vida más corta, como el radio y el radón, que se encuentran en la Tierra, son productos de cadenas de descomposición que comenzaron con los núclidos primordiales o son producto de procesos cosmogénicos en curso, como la producción de carbono-14 de nitrógeno-14 en la atmósfera por los rayos cósmicos. Los radionucleidos también pueden producirse artificialmente en aceleradores de partículas o reactores nucleares, resultando en 650 de ellos con vidas medias de más de una hora y varios miles más con semividas aún más cortas. [Vea aquí una lista de estos ordenados por vida media.]
Historia de descubrimiento
La radioactividad fue descubierta en 1896 por el científico francés Henri Becquerel, mientras trabajaba con materiales fosforescentes. Estos materiales brillan en la oscuridad después de la exposición a la luz, y sospecha que el brillo producido en los tubos de rayos catódicos por los rayos X podría estar asociado con la fosforescencia. Envolvió una placa fotográfica en papel negro y colocó varias sales fosforescentes sobre ella. Todos los resultados fueron negativos hasta que usó sales de uranio. Las sales de uranio causaron un ennegrecimiento de la placa a pesar de que la placa estaba envuelta en papel negro. Estas radiaciones recibieron el nombre de "Rayos de Becquerel".
Pronto quedó claro que el ennegrecimiento de la placa no tenía nada que ver con la fosforescencia, ya que el ennegrecimiento también era producido por sales no fosforescentes de uranio y uranio metálico. Se puso de manifiesto a partir de estos experimentos que había una forma de radiación invisible que podía atravesar el papel y provocar que la placa reaccionara como si estuviera expuesta a la luz.
Al principio, parecía que la nueva radiación era similar a los rayos X recientemente descubiertos. Investigaciones posteriores de Becquerel, Ernest Rutherford, Paul Villard, Pierre Curie, Marie Curie y otros demostraron que esta forma de radioactividad era significativamente más complicada. Rutherford fue el primero en darse cuenta de que todos esos elementos decaen de acuerdo con la misma fórmula matemática exponencial. Rutherford y su alumno Frederick Soddy fueron los primeros en darse cuenta de que muchos procesos de descomposición daban como resultado la transmutación de un elemento a otro. Posteriormente, la ley de desplazamiento radiactivo de Fajans y Soddy se formuló para describir los productos de la desintegración alfa y beta.
Los primeros investigadores también descubrieron que muchos otros elementos químicos, además del uranio, tienen isótopos radiactivos. Una búsqueda sistemática de la radiactividad total en los minerales de uranio también guió a Pierre y Marie Curie a aislar dos elementos nuevos: el polonio y el radio. Excepto por la radioactividad del radio, la similitud química del radio con el bario hizo que estos dos elementos fueran difíciles de distinguir.
El estudio de Marie y Pierre Curie sobre la radioactividad es un factor importante en la ciencia y la medicina. Después de que su investigación sobre los rayos de Becquerel los llevó al descubrimiento del radio y el polonio, acuñaron el término "radioactividad". Su investigación sobre los rayos penetrantes en el uranio y el descubrimiento del radio lanzaron una era de uso del radio para el tratamiento del cáncer. Su exploración del radio podría verse como el primer uso pacífico de la energía nuclear y el comienzo de la medicina nuclear moderna.
Peligros tempranos de salud
Los peligros de la radiación ionizante debida a la radioactividad y los rayos X no se reconocieron de inmediato.
Rayos X
El descubrimiento de los rayos X por Wilhelm Röntgen en 1895 llevó a la experimentación generalizada de científicos, médicos e inventores. Muchas personas comenzaron a contar historias de quemaduras, pérdida de cabello y peores en revistas técnicas ya en 1896. En febrero de ese año, el Profesor Daniel y el Dr. Dudley de la Universidad de Vanderbilt realizaron un experimento que involucraba rayos X en la cabeza de Dudley que causó su pérdida de cabello. . Un informe del Dr. HD Hawks, de su sufrimiento por quemaduras severas de manos y tórax en una demostración de rayos X, fue el primero de muchos otros informes en Electrical Review .
Otros experimentadores, incluidos Elihu Thomson y Nikola Tesla, también informaron quemaduras. Thomson expuso deliberadamente un dedo a un tubo de rayos X durante un período de tiempo y sufrió dolor, hinchazón y ampollas. Otros efectos, como los rayos ultravioleta y el ozono, a veces se culparon por el daño, y muchos médicos aún afirmaron que no había ningún efecto de la exposición a rayos X en absoluto.
A pesar de esto, hubo algunas primeras investigaciones de riesgos sistemáticos, y ya en 1902, William Herbert Rollins escribió casi con desesperación que sus advertencias sobre los peligros involucrados en el uso descuidado de los rayos X no eran atendidos, ni por la industria ni por sus colegas. En ese momento, Rollins había demostrado que los rayos X podían matar a los animales de experimentación, provocar el aborto de un conejillo de Indias preñado y que podrían matar al feto. También hizo hincapié en que "los animales varían en susceptibilidad a la acción externa de X-light" y advirtió que estas diferencias se deben considerar cuando los pacientes fueron tratados por medio de rayos X.
Sustancias radioactivas
Sin embargo, los efectos biológicos de la radiación debida a sustancias radiactivas fueron menos fáciles de medir. Esto brindó la oportunidad a muchos médicos y empresas de comercializar sustancias radiactivas como medicamentos patentados. Algunos ejemplos fueron los tratamientos con enema de radio y las aguas que contienen radio para beber en tónicos. Marie Curie protestó contra este tipo de tratamiento, advirtiendo que los efectos de la radiación en el cuerpo humano no se entendían bien. Curie más tarde murió de anemia aplástica, probablemente causada por la exposición a la radiación ionizante. En la década de 1930, después de varios casos de necrosis ósea y muerte de entusiastas del tratamiento del radio, los medicamentos que contenían radio se habían eliminado en gran parte del mercado (curanderismo radiactivo).
Protección de radiación
Sólo un año después del descubrimiento de Röntgen de rayos X, el ingeniero estadounidense Wolfram Fuchs (1896) dio el que probablemente sea el primer consejo de protección, pero no fue hasta 1925 que se celebró el primer Congreso Internacional de Radiología (ICR) y se consideró establecer protección internacional estándares. Los efectos de la radiación sobre los genes, incluido el efecto del riesgo de cáncer, se reconocieron mucho más tarde. En 1927, Hermann Joseph Muller publicó una investigación que mostraba los efectos genéticos y, en 1946, recibió el Premio Nobel de Fisiología o Medicina por sus hallazgos.
El segundo ICR se celebró en Estocolmo en 1928 y propuso la adopción de la unidad de rógenes, y se formó el "Comité internacional de radiografía y protección contra el radio" (IXRPC). Rolf Sievert fue nombrado presidente, pero una fuerza motriz fue George Kaye del British National Physical Laboratory. El comité se reunió en 1931, 1934 y 1937.
Después de la Segunda Guerra Mundial, el mayor rango y cantidad de sustancias radiactivas manejadas como resultado de los programas nucleares militares y civiles llevó a grandes grupos de trabajadores ocupacionales y al público potencialmente expuesto a niveles dañinos de radiación ionizante. Esto fue considerado en el primer ICR de posguerra convocado en Londres en 1950, cuando nació la actual Comisión Internacional de Protección Radiológica (ICRP). Desde entonces, la ICRP ha desarrollado el actual sistema internacional de protección radiológica, que abarca todos los aspectos del riesgo de radiación.
Unidades de radiactividad
La unidad de actividad radioactiva del Sistema Internacional de Unidades (SI) es el becquerel (Bq), nombrado en honor al científico Henri Becquerel. Un Bq se define como una transformación (o decaimiento o desintegración) por segundo.
Una unidad más antigua de radiactividad es el curie, Ci, que originalmente se definió como "la cantidad o masa de emanación de radio en equilibrio con un gramo de radio (elemento)". Hoy, el curie se define como 3,7 × 10 desintegraciones por segundo, por lo que 1 curie (Ci) = 3,7 × 10 Bq . Con fines de protección radiológica, aunque la Comisión Reguladora Nuclear de los Estados Unidos permite el uso de la unidad curie junto con unidades SI, las directivas de unidades de medida europeas de la Unión Europea exigen que su uso para "fines de salud pública" se elimine antes del 31 de diciembre 1985.
Los efectos de la radiación ionizante a menudo se miden en unidades de gris para daños mecánicos o sievert para el tejido.
Tipos de decaimiento
Los primeros investigadores descubrieron que un campo eléctrico o magnético podría dividir las emisiones radioactivas en tres tipos de haces. A los rayos se les dieron los nombres alfa, beta y gamma, en orden creciente de su capacidad para penetrar en la materia. La desintegración alfa se observa solo en elementos más pesados del número atómico 52 (telurio) y mayor, con la excepción del berilio-8 que se descompone en dos partículas alfa. Los otros dos tipos de decaimiento son producidos por todos los elementos. El plomo, número atómico 82, es el elemento más pesado para tener cualquier isótopo estable (hasta el límite de medición) para la desintegración radiactiva. La descomposición radioactiva se observa en todos los isótopos de todos los elementos del número atómico 83 (bismuto) o superior. Bismuth-209, sin embargo, es muy poco radiactivo, con una vida media mayor que la edad del universo;
Al analizar la naturaleza de los productos de desintegración, era obvio por la dirección de las fuerzas electromagnéticas aplicadas a las radiaciones por campos magnéticos y eléctricos externos que las partículas alfa portaban una carga positiva, las partículas beta llevaban una carga negativa y los rayos gamma eran neutros. Por la magnitud de la deflexión, estaba claro que las partículas alfa eran mucho más masivas que las partículas beta. Pasar partículas alfa a través de una ventana de vidrio muy delgada y atraparlas en un tubo de descarga permitió a los investigadores estudiar el espectro de emisión de las partículas capturadas, y finalmente probó que las partículas alfa son núcleos de helio. Otros experimentos mostraron que la radiación beta, resultante de la descomposición y los rayos catódicos, eran electrones de alta velocidad. Del mismo modo, se descubrió que la radiación gamma y los rayos X son radiación electromagnética de alta energía.
La relación entre los tipos de caries también comenzó a ser examinada: por ejemplo, casi siempre se descubrió que la desintegración gamma estaba asociada con otros tipos de descomposición, y ocurría más o menos al mismo tiempo, o después. La descomposición gamma como un fenómeno separado, con su propia vida media (ahora llamada transición isomérica), se encontró en la radioactividad natural como resultado de la desintegración gamma de los isómeros nucleares metaestables excitados, que a su vez fueron creados a partir de otros tipos de descomposición.
Aunque las radiaciones alfa, beta y gamma se encontraron con mayor frecuencia, finalmente se descubrieron otros tipos de emisión. Poco después del descubrimiento del positrón en los productos de rayos cósmicos, se observó que el mismo proceso que opera en la desintegración beta clásica también puede producir positrones (emisión de positrones), junto con neutrinos (la desintegración beta clásica produce antineutrinos). En un proceso análogo más común, llamado captura de electrones, se descubrió que algunos nucleidos ricos en protones capturan sus propios electrones atómicos en lugar de emitir positrones, y posteriormente estos nucleidos emiten solo un neutrino y un rayo gamma del núcleo excitado (y a menudo también Auger electrones y rayos X característicos, como resultado del reordenamiento de electrones para llenar el lugar del electrón capturado faltante). Estos tipos de descomposición implican la captura nuclear de electrones o la emisión de electrones o positrones, y por lo tanto actúa para mover un núcleo hacia la proporción de neutrones a protones que tiene la menor energía para un número total dado de nucleones. Esto en consecuencia produce un núcleo más estable (energía más baja).
(Un proceso teórico de captura de positrones, análogo a la captura de electrones, es posible en átomos de antimateria, pero no se ha observado, ya que los átomos de antimateria complejos más allá del antihelio no están disponibles experimentalmente. Tal deterioro requeriría átomos de antimateria al menos tan complejos como el berilio 7, que es el isótopo más ligero conocido de la materia normal para sufrir descomposición por captura de electrones).
Poco después del descubrimiento del neutrón en 1932, Enrico Fermi se dio cuenta de que ciertas reacciones raras de beta-decaimiento producen inmediatamente neutrones como una partícula de decaimiento (emisión de neutrones). La emisión de protones aislada finalmente se observó en algunos elementos. También se descubrió que algunos elementos pesados pueden experimentar fisión espontánea en productos que varían en composición. En un fenómeno llamado desintegración de conglomerados, se descubrió que las combinaciones específicas de neutrones y protones distintos de las partículas alfa (núcleos de helio) se emiten espontáneamente desde los átomos.
Se descubrió que otros tipos de desintegración radiactiva emiten partículas vistas previamente, pero a través de diferentes mecanismos. Un ejemplo es la conversión interna, que da como resultado una emisión de electrones inicial y, a menudo, otros rayos X característicos y emisiones de electrones Auger, aunque el proceso de conversión interna no implica ni desintegración beta ni gamma. No se emite un neutrino, y ninguno de los electrones y fotones emitidos se originan en el núcleo, aunque la energía para emitir todos ellos se origina allí. La descomposición interna de la conversión, como la desintegración gamma de transición isomérica y la emisión de neutrones, implica la liberación de energía por un nucleido excitado, sin la transmutación de un elemento en otro.
Se conocen eventos raros que involucran una combinación de dos eventos de tipo de desintegración beta que ocurren simultáneamente (ver más abajo). Se permite que ocurra cualquier proceso de desintegración que no viole la conservación de la energía o las leyes de impulso (y quizás otras leyes de conservación de partículas), aunque no todos han sido detectados. Un ejemplo interesante discutido en una sección final, es la desintegración beta del estado consolidado de renio-187. En este proceso, la desintegración beta de electrones del nucleido parental no se acompaña de la emisión de electrones beta, porque la partícula beta se ha capturado en la capa K del átomo emisor. Se emite un antineutrino, como en todas las desintegraciones beta negativas.
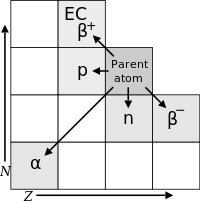
Los radionucleidos pueden experimentar una serie de reacciones diferentes. Estos se resumen en la siguiente tabla. Un núcleo con número de masa A y número atómico Z se representa como ( A, Z ). La columna "Núcleo de hija" indica la diferencia entre el nuevo núcleo y el núcleo original. Por lo tanto, ( A - 1, Z ) significa que el número de masa es uno menos que antes, pero el número atómico es el mismo que antes.
Si las circunstancias energéticas son favorables, un radionúclido dado puede sufrir muchos tipos de descomposición competitivos, con algunos átomos decayendo por una ruta y otros decayendo por otra. Un ejemplo es el cobre 64, que tiene 29 protones y 35 neutrones, que se descompone con una vida media de aproximadamente 12,7 horas. Este isótopo tiene un protón no apareado y un neutrón no emparejado, por lo que el protón o el neutrón pueden decaer a la partícula opuesta. Este núclido en particular (aunque no todos los nucleidos en esta situación) tiene casi la misma probabilidad de desintegrarse a través de la emisión de positrones (18%), o mediante captura de electrones (43%), como a través de la emisión de electrones (39%). Los estados de energía excitados resultantes de estas desintegraciones que no terminan en un estado de energía en el suelo, también producen una conversión interna posterior y desintegración gamma en casi el 0.5% del tiempo.
Más común en nucleidos pesados es la competencia entre la desintegración alfa y beta. Los núclidos descendientes normalmente decaerán a través de beta o alfa, respectivamente, para terminar en el mismo lugar.
| Modo de decaimiento | Partículas participantes | Núcleo hija |
|---|---|---|
| Decaimientos con emisión de nucleones: | ||
| Decaimiento alfa | Una partícula alfa ( A = 4, Z = 2) emitida desde el núcleo | ( A - 4, Z - 2) |
| Emisión de protones | Un protón expulsado del núcleo | ( A - 1, Z - 1) |
| Emisión de neutrones | Un neutrón expulsado del núcleo | ( A - 1, Z ) |
| Doble emisión de protones | Dos protones expulsados del núcleo simultáneamente | ( A - 2, Z - 2) |
| Fisión espontánea | El núcleo se desintegra en dos o más núcleos más pequeños y otras partículas | - |
| Decaimiento del racimo | El núcleo emite un tipo específico de núcleo más pequeño ( A 1 , Z 1 ) que es más grande que una partícula alfa | ( A - A 1 , Z - Z 1 ) + ( A 1 , Z 1 ) |
| Diferentes modos de desintegración beta: | ||
| β decaimiento | Un núcleo emite un electrón y un electrón antineutrino | ( A , Z + 1) |
| Emisión de positrones (βdecay) | Un núcleo emite un positrón y un neutrino de electrones | ( A , Z - 1) |
| Captura de electrones | Un núcleo captura un electrón en órbita y emite un neutrino; el núcleo de la hija queda en un estado inestable excitado | ( A , Z - 1) |
| Desintegración beta de estado enlazado | Un neutrón o núcleo beta libre se descompone en electrón y antineutrino, pero el electrón no se emite, ya que se captura en una capa K vacía; el núcleo de la hija queda en un estado excitado e inestable. Este proceso es una minoría de decaimientos de neutrones libres (0,0004%) debido a la baja energía de ionización de hidrógeno, y se suprime excepto en átomos ionizados que tienen vacantes de caparazón K. | ( A , Z + 1) |
| Doble beta decaimiento | Un núcleo emite dos electrones y dos antineutrinos | ( A , Z + 2) |
| Captura de doble electrón | Un núcleo absorbe dos electrones orbitales y emite dos neutrinos: el núcleo hijas queda en un estado excitado e inestable | ( A , Z - 2) |
| Captura de electrones con emisión de positrones | Un núcleo absorbe un electrón orbital, emite un positrón y dos neutrinos | ( A , Z - 2) |
| Doble emisión de positrones | Un núcleo emite dos positrones y dos neutrinos | ( A , Z - 2) |
| Transiciones entre estados del mismo núcleo: | ||
| Transición isomérica | El núcleo excitado libera un fotón de alta energía (rayos gamma) | ( A , Z ) |
| Conversión interna | El núcleo excitado transfiere energía a un electrón orbital, que posteriormente es expulsado del átomo | ( A , Z ) |
La desintegración radiactiva produce una reducción de la masa de reposo sumada, una vez que la energía liberada (la energía de desintegración ) ha escapado de alguna manera. Aunque la energía de desintegración a veces se define como asociada a la diferencia entre la masa de los productos del nucleido principal y la masa de los productos de desintegración, esto solo se aplica a las mediciones de masa en reposo, donde se ha eliminado algo de energía del sistema del producto. Esto es cierto porque la energía de decaimiento siempre debe llevar masa, donde sea que aparezca (ver masa en relatividad especial) de acuerdo con la fórmula E = mc. La energía de decaimiento se libera inicialmente como la energía de los fotones emitidos más la energía cinética de las partículas emitidas masivas (es decir, partículas que tienen masa en reposo). Si estas partículas llegan a un equilibrio térmico con su entorno y se absorben los fotones, la energía de desintegración se transforma en energía térmica, que retiene su masa.
Por lo tanto, la energía de decaimiento sigue estando asociada con una cierta medida de masa del sistema de descomposición, llamada masa invariante, que no cambia durante la descomposición, aunque la energía de la descomposición se distribuye entre las partículas de descomposición. La energía de los fotones, la energía cinética de las partículas emitidas y, más tarde, la energía térmica de la materia circundante, contribuyen a la masa invariante del sistema. Por lo tanto, mientras que la suma de las masas en reposo de las partículas no se conserva en la desintegración radiactiva, el sistema de masa y el sistema de masa invariante (y también la energía total del sistema) se conserva a través de cualquier proceso de desintegración. Esta es una reformulación de las leyes equivalentes de conservación de la energía y conservación de la masa.
Tasas de desintegración radiactiva
La tasa de descomposición o actividad de una sustancia radiactiva se caracteriza por:
Cantidades constantes :
- La vida media - t 1/2 , es el tiempo que tarda la actividad de una cantidad dada de una sustancia radiactiva en decaer a la mitad de su valor inicial; ver la lista de nucleidos
- La constante de decaimiento - λ , "lambda", el recíproco de la duración media, a veces denominada tasa de descomposición simple .
- La vida media - τ , "tau" el promedio de vida (1 / e vida) de una partícula radiactiva antes de la descomposición.
Aunque estas son constantes, están asociadas con el comportamiento estadístico de las poblaciones de átomos. En consecuencia, las predicciones que usan estas constantes son menos precisas para muestras minúsculas de átomos.
En principio, una vida media, una tercera vida o incluso una vida (1 / √ 2 ) se pueden usar exactamente de la misma manera que la vida media; pero la vida media y la semivida t 1/2 han sido adoptadas como tiempos estándar asociados con el decaimiento exponencial.
Cantidades variables en el tiempo :
- Actividad total : A , es el número de desintegraciones por unidad de tiempo de una muestra radiactiva.
- Número de partículas : N , es el número total de partículas en la muestra.
- Actividad específica - S A , número de desintegraciones por unidad de tiempo por cantidad de sustancia de la muestra en el tiempo establecido en cero ( t = 0). La "cantidad de sustancia" puede ser la masa, el volumen o los moles de la muestra inicial.
Estos se relacionan de la siguiente manera:
donde N 0 es la cantidad inicial de sustancia activa, sustancia que tiene el mismo porcentaje de partículas inestables que cuando se formó la sustancia.
Matemáticas de la desintegración radiactiva
Ley universal de decaimiento radiactivo
La radiactividad es un ejemplo muy frecuente de descomposición exponencial. La ley describe el comportamiento estadístico de un gran número de núclidos, en lugar de átomos individuales. En el siguiente formalismo, el número de nucleidos o la población de núclidos N es, por supuesto, una variable discreta (un número natural), pero para cualquier muestra física, N es tan grande que puede tratarse como una variable continua. El cálculo diferencial se usa para modelar el comportamiento de la descomposición nuclear.
Las matemáticas de la desintegración radiactiva dependen de la suposición clave de que un núcleo de un radionúclido no tiene "memoria" o forma de traducir su historia a su comportamiento actual. Un núcleo no "envejece" con el paso del tiempo. Por lo tanto, la probabilidad de su descomposición no aumenta con el tiempo, sino que se mantiene constante sin importar cuánto tiempo haya existido el núcleo. Esta probabilidad constante puede variar mucho entre los diferentes tipos de núcleos, lo que lleva a las diferentes tasas de descomposición observadas. Sin embargo, cualquiera que sea la probabilidad, no cambia. Esto está en marcado contraste con los objetos complejos que muestran envejecimiento, como automóviles y humanos. Estos sistemas tienen una posibilidad de descomposición por unidad de tiempo, que aumenta desde el momento en que comienzan su existencia.
Proceso de decaimiento
Considere el caso de un núclido A que se descompone en otro B mediante algún proceso A → B (emisión de otras partículas, como neutrinos de electrones
ν
e y los electrones e como en la desintegración beta, son irrelevantes en lo que sigue). La descomposición de un núcleo inestable es completamente aleatoria en el tiempo, por lo que es imposible predecir cuándo decaerá un átomo en particular. Sin embargo, es igualmente probable que se descomponga en cualquier instante en el tiempo. Por lo tanto, dada una muestra de un radioisótopo particular, el número de eventos de decaimiento -d N que se espera que ocurra en un pequeño intervalo de tiempo d t es proporcional al número de átomos presentes N , es decir
ν
e y los electrones e como en la desintegración beta, son irrelevantes en lo que sigue). La descomposición de un núcleo inestable es completamente aleatoria en el tiempo, por lo que es imposible predecir cuándo decaerá un átomo en particular. Sin embargo, es igualmente probable que se descomponga en cualquier instante en el tiempo. Por lo tanto, dada una muestra de un radioisótopo particular, el número de eventos de decaimiento -d N que se espera que ocurra en un pequeño intervalo de tiempo d t es proporcional al número de átomos presentes N , es decir
Los radionucleidos particulares se descomponen a diferentes velocidades, por lo que cada uno tiene su propia constante de desintegración λ . La caída esperada -d N / N es proporcional a un incremento de tiempo, d t :
El signo negativo indica que N disminuye a medida que aumenta el tiempo, ya que los eventos de desintegración se suceden uno tras otro. La solución a esta ecuación diferencial de primer orden es la función:
donde N 0 es el valor de N en el tiempo t = 0, con la constante de decaimiento expresada como λ o 1 / τ
Tenemos todo el tiempo t :
donde N total es el número constante de partículas durante el proceso de desintegración, que es igual al número inicial de nucleidos A ya que esta es la sustancia inicial.
Si la cantidad de núcleos A no descompuestos es:
entonces el número de núcleos de B , es decir, el número de núcleos A decaídos , es
El número de desintegraciones observadas en un intervalo dado obedece a las estadísticas de Poisson. Si el número promedio de desintegraciones es <N> , la probabilidad de un número dado de desintegraciones es N
Procesos de decaimiento de cadena
Cadena de dos decaimientos
Consideremos ahora el caso de una cadena de dos desintegraciones: un nucleido A en descomposición en otro B por un proceso, entonces B en descomposición en otro C por un segundo proceso, es decir A → B → C . La ecuación anterior no se puede aplicar a la cadena de decaimiento, pero se puede generalizar de la siguiente manera. Desde A desintegra en B , entonces B se desintegra en C , la actividad de A se añade a la cantidad total de B nucleidos en la presente muestra, antes de los B la descomposición de núclidos y reduce el número de nucleidos que conducen a la muestra posterior. En otras palabras, el número de núcleos B de segunda generación aumenta como resultado de la descomposición de núcleos de primera generación de A , y disminuye como resultado de su propia descomposición en los núcleos C detercera generación . La suma de estos dos términos da la ley para una cadena de decaimiento para dos nucleidos:
La velocidad de cambio de N B , que es d N B / d t , está relacionada con los cambios en las cantidades de A y B , N B puede aumentar como B se produce a partir de A y disminución como B produce C .
Reescribiendo con los resultados anteriores:
Los subíndices se refieren simplemente a los respectivos nucleidos, es decir, N A es el número de nucleidos de tipo A , N A 0 es el número inicial de nucleidos de tipo A , λ A es la constante de atenuación de A - y de manera similar para nucleido B . La resolución de esta ecuación para N B da:
En el caso en que B es un núclido estable ( λ B = 0), esta ecuación se reduce a la solución anterior:
como se muestra arriba para un decaimiento. La solución se puede encontrar mediante el método del factor de integración, donde el factor de integración es e . Este caso es quizás el más útil, ya que puede derivar tanto la ecuación de decaimiento único (arriba) como la ecuación para cadenas de decaimiento múltiple (abajo) más directamente.
Cadena de cualquier cantidad de decaimientos
Para el caso general de cualquier número de decaimientos consecutivos en una cadena de decaimiento, es decir, A 1 → A 2 ••• → A i ••• → A D , donde D es el número de decaimientos e i es un índice ficticio ( i = 1, 2, 3, ... D ), cada población de nucleidos se puede encontrar en términos de la población anterior. En este caso N 2 = 0 , N 3 = 0 , ..., N D = 0 . Usando el resultado anterior en una forma recursiva:
La solución general al problema recursivo viene dada por las ecuaciones de Bateman :
Ecuaciones de Bateman
Modos de decaimiento alternativos
En todos los ejemplos anteriores, el núclido inicial se descompone en un solo producto. Considere el caso de un nucleido inicial que puede descomponerse en cualquiera de los dos productos, es decir A → B y A → C en paralelo. Por ejemplo, en una muestra de potasio-40, 89.3% de los núcleos se descomponen en calcio-40 y 10.7% en argón-40. Tenemos todo el tiempo t :
que es constante, ya que el número total de nucleidos permanece constante. Diferenciando con respecto al tiempo:
definiendo la constante de decaimiento total λ en términos de la suma de las constantes de decaimiento parcial λ B y λ C :
Darse cuenta de
Resolviendo esta ecuación para N A :
donde N A 0 es el número inicial de nucleido A. Al medir la producción de un nucleido, solo se puede observar la constante de decaimiento total λ . Las constantes de decaimiento λ B y λ C determinan la probabilidad de que el decaimiento produzca los productos B o C de la siguiente manera:
porque la fracción λ B / λ de decadencia núcleos en B mientras que la fracción λ C / λ de decadencia núcleos en C .
Corolarios de las leyes de decaimiento
Las ecuaciones anteriores también se pueden escribir usando cantidades relacionadas con el número de partículas de núclidos N en una muestra;
- La actividad: A = λN.
- La cantidad de sustancia: n = N / L .
- La masa: M = A r n = A r N / L .
donde L = 6.022 × 10 es la constante de Avogadro, A r es el número relativo de masa atómica, y la cantidad de la sustancia está en moles.
Tiempo de decaimiento: definiciones y relaciones
Tiempo constante y vida media
Para la solución de una sola caída A → B :
la ecuación indica que la constante de decaimiento λ tiene unidades de t , y por lo tanto también se puede representar como 1 / τ , donde τ es un tiempo característico del proceso llamado constante de tiempo .
En un proceso de desintegración radiactiva, esta constante de tiempo también es la vida media de los átomos en descomposición. Cada átomo "vive" durante un tiempo finito antes de que se descomponga, y se puede demostrar que esta duración media es la media aritmética de todas las vidas de los átomos, y que es τ , que de nuevo está relacionado con la constante de desintegración como sigue:
Esta forma también es válida para procesos de dos decadencias simultáneamente A → B + C , insertando los valores equivalentes de las constantes de decaimiento (como se indicó anteriormente)
en la solución de decaimiento conduce a:
Media vida
Un parámetro más comúnmente utilizado es la vida media. Dada una muestra de un radionúclido en particular, la vida media es el tiempo que tarda la mitad de los átomos del radionúclido en descomponerse. Para el caso de reacciones nucleares de una sola descomposición:
la vida media está relacionado con la constante de desintegración de la siguiente manera: Conjunto de N = N 0 /2 y t = T medio para obtener
Esta relación entre la semivida y la constante de desintegración muestra que las sustancias altamente radiactivas se gastan rápidamente, mientras que las que irradian débilmente duran más tiempo. Las semividas de los radionucleidos conocidos varían ampliamente, desde más de 10 años, como para el nuclide Bi casi estable, hasta 10 segundos para los altamente inestables.
El factor de ln (2) en las relaciones anteriores resulta del hecho de que el concepto de "vida media" es simplemente una forma de seleccionar una base diferente a la base natural e para la expresión de la vida. La constante de tiempo τ es la vida e -1 , el tiempo hasta que solo queda 1 / e , alrededor del 36,8%, en lugar del 50% en la vida media de un radionúclido. Por lo tanto, τ es más largo que t 1/2 . La siguiente ecuación puede mostrarse válida:
Como la desintegración radiactiva es exponencial con una probabilidad constante, cada proceso podría describirse tan fácilmente con un período de tiempo constante diferente que (por ejemplo) dio su "(1/3) -vida" (cuánto tiempo hasta que solo quede 1/3) o "(1/10) -life" (un período de tiempo hasta que solo quede el 10%), y así sucesivamente. Por lo tanto, la elección de τ y t 1/2 para los tiempos de los marcadores, son solo por conveniencia y por convención. Reflejan un principio fundamental solo en la medida en que muestran que la misma proporción de una sustancia radiactiva dada se descompondrá, durante cualquier período de tiempo que uno elija.
Matemáticamente, la n vida para la situación anterior se encontraría de la misma manera que la anterior, estableciendo N = N 0 / n , t = T 1 / ny sustituyendo en la solución de decaimiento para obtener
Ejemplo
Una muestra de C tiene una vida media de 5.730 años y una tasa de descomposición de 14 desintegración por minuto (dpm) por gramo de carbono natural.
Si se encuentra que un artefacto tiene radiactividad de 4 dpm por gramo de su C presente, podemos encontrar la edad aproximada del objeto usando la ecuación anterior:
dónde:
- años,
- años.
Cambiando las tasas de decaimiento
Se sabe que los modos de desintegración radioactiva de captura electrónica y conversión interna son ligeramente sensibles a los efectos químicos y ambientales que cambian la estructura electrónica del átomo, lo que a su vez afecta la presencia de electrones 1s y 2s que participan en el proceso de descomposición. Un pequeño número de núclidos principalmente ligeros se ven afectados. Por ejemplo, los enlaces químicos pueden afectar la tasa de captura de electrones en un pequeño grado (en general, menos del 1%) dependiendo de la proximidad de los electrones al núcleo. En Be, se ha observado una diferencia de 0.9% entre las vidas medias en ambientes metálicos y aislantes. Este efecto relativamente grande es porque el berilio es un átomo pequeño cuyos electrones de valencia están en 2s orbitales atómicos, que son objeto de captura de electrones en deberse a que (como todo s los orbitales atómicos de todos los átomos) que, naturalmente, penetran en el núcleo.
En 1992, Jung et al. del grupo de investigación de iones pesados Darmstadt observó una decadencia β acelerada de Dy. Aunque el Dy neutral es un isótopo estable, el Dyundergoes β completamente ionizado se descompone en las conchas K y L en Ho con una vida media de 47 días.
Rhenium-187 es otro ejemplo espectacular. Normalmente, la beta se descompone en Os con una vida media de 41,6 × 10 años, pero los estudios que utilizan átomos de Re totalmente ionizados (núcleos desnudos) han descubierto que esto puede disminuir a solo 33 años. Esto se atribuye a la "descomposición β del estado ligado" del átomo completamente ionizado: el electrón se emite en la "capa K" ( orbital atómico 1s ), lo cual no puede ocurrir para los átomos neutros en los que todos los estados limitados están ocupados .
Varios experimentos han encontrado que las tasas de descomposición de otros modos de radioisótopos artificiales y naturales son, en un alto grado de precisión, no afectadas por condiciones externas tales como la temperatura, la presión, el entorno químico y los campos eléctricos, magnéticos o gravitacionales. Comparación de experimentos de laboratorio durante el último siglo, estudios del reactor nuclear natural Oklo (que ejemplificó los efectos de los neutrones térmicos en la descomposición nuclear) y observaciones astrofísicas de las desintegraciones de luminosidad de las supernovas distantes (que ocurrieron muy lejos para que la luz gran cantidad de tiempo para llegar hasta nosotros), por ejemplo, indican fuertemente que las tasas de deterioro sin perturbaciones han sido constantes (al menos dentro de las limitaciones de pequeños errores experimentales) como una función del tiempo también.
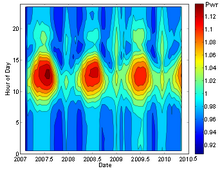
Los resultados recientes sugieren la posibilidad de que las tasas de descomposición puedan tener una dependencia débil de los factores ambientales. Se ha sugerido que las mediciones de las tasas de descomposición de silicio-32, manganeso-54 y radio-226 presentan pequeñas variaciones estacionales (del orden de 0.1%). Sin embargo, tales mediciones son altamente susceptibles a errores sistemáticos, y un artículo posterior no ha encontrado evidencia de tales correlaciones en otros siete isótopos (Na, Ti, Ag, Sn, Ba, Am, Pu), y establece límites superiores en el tamaño de cualquiera de esos efectos. La desintegración del radón-222 se informó una vez que presentaba grandes variaciones estacionales de 4% pico a pico (ver diagrama), que se propuso que estaban relacionadas con la actividad del destello solar o la distancia del Sol, pero el análisis detallado del experimento defectos de diseño, junto con comparaciones con otros,
Anomalía GSI
Una serie inesperada de resultados experimentales para la velocidad de descomposición de los iones radiactivos pesados altamente cargados que circulan en un anillo de almacenamiento ha provocado actividad teórica en un esfuerzo por encontrar una explicación convincente. Se encontró que las tasas de decaimiento débil de dos especies radiactivas con vida media de aproximadamente 40 sy 200 s tienen una modulación oscilatoria significativa, con un período de aproximadamente 7 s. El fenómeno observado se conoce como la anomalía GSI, ya que el anillo de almacenamiento es una instalación en el Centro GSI Helmholtz para Investigación de Iones Pesados en Darmstadt, Alemania. Como el proceso de descomposición produce un neutrino de electrones, algunas de las explicaciones propuestas para la oscilación de velocidad observada invocan propiedades de neutrinos. Las ideas iniciales relacionadas con la oscilación del sabor se encontraron con escepticismo. Una propuesta más reciente implica diferencias masivas entre los estados propios de la masa de neutrinos.
Base teórica de los fenómenos de decaimiento
Los neutrones y protones que constituyen los núcleos, así como otras partículas que se acercan lo suficiente a ellos, se rigen por varias interacciones. La fuerza nuclear fuerte, no observada en la escala macroscópica familiar, es la fuerza más poderosa en distancias subatómicas. La fuerza electrostática es casi siempre significativa y, en el caso de la desintegración beta, la fuerza nuclear débil también está involucrada.
Los efectos combinados de estas fuerzas producen una serie de fenómenos diferentes en los que la energía puede liberarse mediante la reorganización de partículas en el núcleo, o bien el cambio de un tipo de partícula en otros. Estos reordenamientos y transformaciones pueden verse obstaculizados enérgicamente, de modo que no se producen de inmediato. En ciertos casos, las fluctuaciones de vacío cuántico aleatorio se teorizan para promover la relajación a un estado de energía más bajo (la "decadencia") en un fenómeno conocido como túnel cuántico. La vida media de desintegración radiactiva de los núclidos se ha medido en escalas de tiempo de 55 órdenes de magnitud, desde 2,3 × 10 segundos (para el hidrógeno-7) hasta 6,9 × 10 segundos (para el telurio-128). Los límites de estas escalas de tiempo se establecen por la sensibilidad de la instrumentación solamente,
El proceso de desintegración, como todas las transformaciones de energía obstaculizadas, puede ser analizado por un campo de nieve en una montaña. Si bien la fricción entre los cristales de hielo puede estar soportando el peso de la nieve, el sistema es inherentemente inestable con respecto a un estado de menor energía potencial. Una perturbación facilitaría así el camino hacia un estado de mayor entropía; el sistema se moverá hacia el estado fundamental, produciendo calor, y la energía total será distribuible en un mayor número de estados cuánticos, lo que resultará en una avalancha. La energía total no cambia en este proceso, pero, debido a la segunda ley de la termodinámica, las avalanchas solo se han observado en una dirección y eso es hacia el "estado fundamental": el estado con el mayor número de formas en las que el la energía podría ser distribuida.
Tal colapso (un evento de desintegración de rayos gamma ) requiere una energía de activación específica. Para una avalancha de nieve, esta energía viene como una perturbación desde el exterior del sistema, aunque tales perturbaciones pueden ser arbitrariamente pequeñas. En el caso de un núcleo atómico excitado que se descompone por radiación gamma en una emisión espontánea de radiación electromagnética, la perturbación arbitrariamente pequeña proviene de las fluctuaciones de vacío cuántico.
Un núcleo radiactivo (o cualquier sistema excitado en la mecánica cuántica) es inestable y, por lo tanto, puede estabilizarse espontáneamente en un sistema menos excitado. La transformación resultante altera la estructura del núcleo y da como resultado la emisión de un fotón o una partícula de alta velocidad que tiene masa (como un electrón, una partícula alfa u otro tipo).
Ocurrencia y aplicaciones
Según la teoría del Big Bang, los isótopos estables de los cinco elementos más ligeros (H, He y trazas de Li, Be y B) se produjeron poco después de la aparición del universo, en un proceso llamado nucleosíntesis de Big Bang. Estos nucleidos estables más livianos (incluyendo el deuterio) sobreviven hoy en día, pero cualquier isótopo radioactivo de los elementos ligeros producidos en el Big Bang (como el tritio) hace tiempo que se descompuso. Los isótopos de elementos más pesados que el boro no se produjeron en absoluto en el Big Bang, y estos primeros cinco elementos no tienen ningún radioisótopo de larga vida. Por lo tanto, todos los núcleos radiactivos son, por lo tanto, relativamente jóvenes con respecto al nacimiento del universo, habiéndose formado posteriormente en varios otros tipos de nucleosíntesis en estrellas (en particular, supernovas), y también durante las interacciones en curso entre los isótopos estables y las partículas energéticas. Por ejemplo, el carbono 14, un nucleido radiactivo con una vida media de solo 5.730 años, se produce constantemente en la atmósfera superior de la Tierra debido a las interacciones entre los rayos cósmicos y el nitrógeno.
Los nucleidos que se producen por la desintegración radiactiva se llaman nucleidos radiogénicos, ya sean ellos mismos estables o no. Existen núclidos radiogénicos estables que se formaron a partir de radionucleidos extintos de vida corta en el sistema solar primitivo. La presencia extra de estos nucleidos radiogénicos estables (tales como Xe-129 de I-129 primordial) en el contexto de nucleidos estables primordiales se puede inferir por diversos medios.
La descomposición radioactiva se usó en la técnica del etiquetado radioisotópico, que se usa para rastrear el paso de una sustancia química a través de un sistema complejo (como un organismo vivo). Una muestra de la sustancia se sintetiza con una alta concentración de átomos inestables. La presencia de la sustancia en una u otra parte del sistema se determina detectando las ubicaciones de los eventos de decaimiento.
Sobre la premisa de que la desintegración radiactiva es verdaderamente aleatoria (en lugar de simplemente caótica), se ha utilizado en generadores de números aleatorios de hardware. Debido a que no se cree que el proceso varíe significativamente en el mecanismo a lo largo del tiempo, también es una herramienta valiosa para estimar las edades absolutas de ciertos materiales. Para los materiales geológicos, los radioisótopos y algunos de sus productos de descomposición quedan atrapados cuando se solidifica una roca, y luego pueden ser utilizados (sujeto a muchas calificaciones bien conocidas) para estimar la fecha de la solidificación. Estos incluyen verificar los resultados de varios procesos simultáneos y sus productos uno contra el otro, dentro de la misma muestra. De manera similar, y también sujeto a calificación, la tasa de formación de carbono-14 en varias épocas, se puede estimar la fecha de formación de la materia orgánica dentro de un cierto período relacionado con la vida media del isótopo, porque el carbono-14 se atrapa cuando la materia orgánica crece e incorpora el nuevo carbono-14 del aire. Posteriormente, la cantidad de carbono-14 en la materia orgánica disminuye de acuerdo con procesos de descomposición que también pueden verificarse de forma independiente por otros medios (como la comprobación del carbono-14 en anillos de árboles individuales, por ejemplo).
Efecto Szilard-Chalmers
El efecto Szilard-Chalmers se define como la ruptura de un enlace químico entre un átomo y la molécula de la que forma parte el átomo, como resultado de una reacción nuclear del átomo. El efecto se puede usar para separar isótopos por medios químicos. El descubrimiento de este efecto se debe a L. Szilárd y TA Chalmers.
Orígenes de nucleidos radiactivos
Los nucleidos primordiales radiactivos que se encuentran en la Tierra son residuos de antiguas explosiones de supernova que ocurrieron antes de la formación del sistema solar. Son la fracción de radionucleidos que sobrevivieron desde ese momento, a través de la formación de la nebulosa solar primordial, a través de la acreción del planeta y hasta el momento presente. Los radionucleidos radiogénicos de vida corta de ocurrencia natural que se encuentran en las rocas de hoy en día son las hijas de esos nucleidos primordiales radiactivos. Otra fuente menor de nucleidos radiactivos de origen natural son los núclidos cosmogénicos, que se forman por el bombardeo de rayos cósmicos de material en la atmósfera o la corteza de la Tierra. La descomposición de los radionucleidos en las rocas del manto y la corteza de la Tierra contribuye significativamente al presupuesto de calor interno de la Tierra.
Cadenas de decaimiento y modos múltiples
El nucleido hijo de un evento de decaimiento también puede ser inestable (radioactivo). En este caso, también se descompondrá, produciendo radiación. El segundo nucleido hijo resultante también puede ser radiactivo. Esto puede conducir a una secuencia de varios eventos de desintegración llamada cadena de desintegración (consulte este artículo para obtener detalles específicos de cadenas de desintegración natural importantes). Finalmente, se produce un núclido estable.
Un ejemplo es la cadena de descomposición natural de U:
- El uranio-238 se descompone, a través de la emisión alfa, con una vida media de 4.500 millones de años a torio-234
- que se descompone, a través de la emisión beta, con una vida media de 24 días a protactinio-234
- que se descompone, a través de la emisión beta, con una vida media de 1,2 minutos a uranio-234
- que decae, a través de la emisión alfa, con una vida media de 240 mil años a torio-230
- que decae, a través de la emisión alfa, con una vida media de 77 mil años a radio-226
- que decae, a través de la emisión alfa, con una vida media de 1.6 mil años al radón-222
- que decae, a través de la emisión alfa, con una vida media de 3.8 días a polonio-218
- que se descompone, a través de la emisión alfa, con una vida media de 3.1 minutos a plomo-214
- que se descompone, a través de la emisión beta, con una vida media de 27 minutos a bismuto-214
- que se descompone, a través de la emisión beta, con una vida media de 20 minutos a polonio-214
- que decae, a través de la emisión alfa, con una vida media de 160 microsegundos a plomo-210
- que se descompone, a través de la emisión beta, con una vida media de 22 años a bismuto-210
- que se descompone, a través de una emisión beta, con una vida media de 5 días a polonio-210
- que decae, a través de la emisión alfa, con una vida media de 140 días para conducir-206, que es un núclido estable.
Algunos radionucleidos pueden tener diferentes caminos de descomposición. Por ejemplo, aproximadamente el 36% de bismuto-212 se descompone, a través de la emisión alfa, a talio-208, mientras que aproximadamente el 64% de bismuto-212 se descompone, a través de la emisión beta, al polonio-212. Tanto el talio-208 como el polonio-212 son productos radiactivos secundarios de bismuto-212, y ambos se descomponen directamente en plomo-208 estable.
Señales de advertencia de peligro asociadas
 El símbolo trébol usado para indicar radiación ionizante.
El símbolo trébol usado para indicar radiación ionizante. Símbolo de peligro de radiactividad ISO 2007 destinado a las fuentes de IAEA de las categorías 1, 2 y 3 definidas como fuentes peligrosas que pueden causar la muerte o lesiones graves.
Símbolo de peligro de radiactividad ISO 2007 destinado a las fuentes de IAEA de las categorías 1, 2 y 3 definidas como fuentes peligrosas que pueden causar la muerte o lesiones graves. El signo de clasificación de transporte de mercancías peligrosas para materiales radiactivos
El signo de clasificación de transporte de mercancías peligrosas para materiales radiactivos





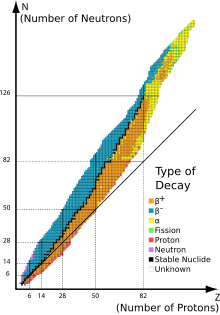













![\ lim _ {\ lambda _ {B} \ rightarrow 0} \ left [{\ frac {N_ {A0} \ lambda _ {A}} {\ lambda _ {B} - \ lambda _ {A}}} \ left (e ^ {- \ lambda _ {A} t} -e ^ {- \ lambda _ {B} t} \ right) \ right] = {\ frac {N_ {A0} \ lambda _ {A}} {0 - \ lambda _ {A}}} \ left (e ^ {- \ lambda _ {A} t} -1 \ right) = N_ {A0} \ left (1-e ^ {- \ lambda _ {A} t }\derecho),](https://wikimedia.org/api/rest_v1/media/math/render/svg/982ae50245eea1305c63a7b97be54ea1e2a19ccf)