Átomo
Definición
| Átomo de helio | ||||||||
|---|---|---|---|---|---|---|---|---|
 | ||||||||
| Una ilustración del átomo de helio, que representa el núcleo (rosa) y la distribución de la nube de electrones (negro). El núcleo (arriba a la derecha) en helio-4 es en realidad esféricamente simétrico y se asemeja mucho a la nube de electrones, aunque para núcleos más complicados este no es siempre el caso. La barra negra es una angstrom ( 10 m o 100 p . M. ). | ||||||||
| Clasificación | ||||||||
| ||||||||
| Propiedades | ||||||||
|
Un átomo es la unidad constituyente más pequeña de la materia ordinaria que tiene las propiedades de un elemento químico. Cada sólido, líquido, gas y plasma está compuesto de átomos neutros o ionizados. Los átomos son extremadamente pequeños; los tamaños típicos son alrededor de 100 picómetros (una diezmil millonésima de metro, en la escala corta).
Los átomos son lo suficientemente pequeños como para intentar predecir su comportamiento utilizando la física clásica, como si fueran bolas de billar, por ejemplo, da predicciones notablemente incorrectas debido a los efectos cuánticos. A través del desarrollo de la física, los modelos atómicos han incorporado principios cuánticos para explicar y predecir mejor este comportamiento.
Cada átomo se compone de un núcleo y uno o más electrones unidos al núcleo. El núcleo está hecho de uno o más protones y típicamente una cantidad similar de neutrones. Los protones y neutrones se llaman nucleones. Más del 99.94% de la masa de un átomo está en el núcleo. Los protones tienen una carga eléctrica positiva, los electrones tienen una carga eléctrica negativa y los neutrones no tienen carga eléctrica. Si la cantidad de protones y electrones es igual, ese átomo es eléctricamente neutro. Si un átomo tiene más o menos electrones que protones, entonces tiene una carga global negativa o positiva, respectivamente, y se llama ion.
Los electrones de un átomo son atraídos por los protones en un núcleo atómico por esta fuerza electromagnética. Los protones y neutrones en el núcleo se atraen entre sí por una fuerza diferente, la fuerza nuclear, que generalmente es más fuerte que la fuerza electromagnética que repele a los protones cargados positivamente entre sí. Bajo ciertas circunstancias, la fuerza electromagnética repelente se vuelve más fuerte que la fuerza nuclear, y los nucleones pueden ser expulsados del núcleo, dejando atrás un elemento diferente: la descomposición nuclear que resulta en la transmutación nuclear.
El número de protones en el núcleo define a qué elemento químico pertenece el átomo: por ejemplo, todos los átomos de cobre contienen 29 protones. La cantidad de neutrones define el isótopo del elemento. La cantidad de electrones influye en las propiedades magnéticas de un átomo. Los átomos se pueden unir a uno o más átomos por enlaces químicos para formar compuestos químicos tales como moléculas. La capacidad de los átomos para asociarse y disociarse es responsable de la mayoría de los cambios físicos observados en la naturaleza y es el sujeto de la disciplina de la química.
Historia de la teoría atómica
Átomos en filosofía
La idea de que la materia se compone de unidades discretas es una idea muy antigua, que aparece en muchas culturas antiguas como Grecia y la India. La palabra "átomo" fue acuñada por los antiguos filósofos griegos Leucipo y su discípulo Demócrito. Sin embargo, estas ideas se fundaron en el razonamiento filosófico y teológico más que en la evidencia y la experimentación. Como resultado, sus puntos de vista sobre cómo se ven los átomos y cómo se comportan eran incorrectos. Tampoco pudieron convencer a todos, por lo que el atomismo no era más que una de varias teorías en competencia sobre la naturaleza de la materia. No fue sino hasta el siglo XIX que la idea fue adoptada y refinada por los científicos, cuando la floreciente ciencia de la química produjo descubrimientos que solo el concepto de átomos podría explicar.
Primera teoría basada en la evidencia
Dalton también creía que la teoría atómica podría explicar por qué el agua absorbe diferentes gases en diferentes proporciones. Por ejemplo, descubrió que el agua absorbe dióxido de carbono mucho mejor de lo que absorbe nitrógeno. Dalton formuló la hipótesis de que esto se debía a las diferencias entre las masas y las configuraciones de las partículas respectivas de los gases, y las moléculas de dióxido de carbono (CO 2 ) son más pesadas y más grandes que las moléculas de nitrógeno (N 2 ).
movimiento browniano
En 1827, el botánico Robert Brown usó un microscopio para observar los granos de polvo que flotaban en el agua y descubrió que se movían erráticamente, un fenómeno que se hizo conocido como "movimiento browniano". Se cree que esto fue causado por moléculas de agua que derribaron los granos. En 1905, Albert Einstein probó la realidad de estas moléculas y sus movimientos produciendo el primer análisis estadístico de física del movimiento browniano. El físico francés Jean Perrin utilizó el trabajo de Einstein para determinar experimentalmente la masa y las dimensiones de los átomos, verificando de manera concluyente la teoría atómica de Dalton.
Descubrimiento del electrón
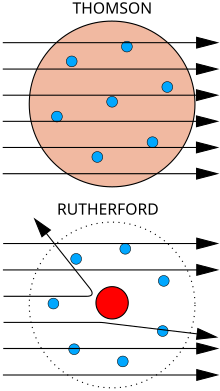
El físico JJ Thomson midió la masa de rayos catódicos, mostrando que estaban hechos de partículas, pero eran aproximadamente 1800 veces más livianos que el átomo más ligero, el hidrógeno. Por lo tanto, no eran átomos, sino una nueva partícula, la primera partícula subatómica que se descubrió, que originalmente llamó " corpúsculo " pero que más tarde se denominó electrón., después de partículas postuladas por George Johnstone Stoney en 1874. También mostró que eran idénticas a las partículas emitidas por materiales fotoeléctricos y radiactivos. Rápidamente se reconoció que son las partículas que llevan corrientes eléctricas en los alambres de metal y llevan la carga eléctrica negativa dentro de los átomos. Thomson recibió el Premio Nobel de Física 1906 por este trabajo. Por lo tanto, anuló la creencia de que los átomos son las partículas últimas e indivisibles de la materia. Thomson también postuló erróneamente que los electrones de baja masa y carga negativa se distribuyeron por todo el átomo en un mar uniforme de carga positiva. Esto se hizo conocido como el modelo de budín de ciruela.
Descubrimiento del núcleo
En 1909, Hans Geiger y Ernest Marsden, bajo la dirección de Ernest Rutherford, bombardearon una lámina de metal con partículas alfa para observar cómo se dispersaron. Esperaban que todas las partículas alfa pasaran directamente con poca deflexión, porque el modelo de Thomson decía que las cargas en el átomo son tan difusas que sus campos eléctricos no podrían afectar demasiado a las partículas alfa. Sin embargo, Geiger y Marsden detectaron partículas alfa que se desviaban en ángulos superiores a 90 °, lo que se suponía imposible según el modelo de Thomson. Para explicar esto, Rutherford propuso que la carga positiva del átomo se concentra en un pequeño núcleo en el centro del átomo. Rutherford comparó sus hallazgos con uno disparando un proyectil de 15 pulgadas contra una hoja de papel de seda y volviendo para golpear a la persona que lo disparó.
Descubrimiento de isótopos
Mientras experimentaba con los productos de la desintegración radiactiva, en 1913 el radioquímico Frederick Soddy descubrió que parecía haber más de un tipo de átomo en cada posición de la tabla periódica. El término isótopo fue acuñado por Margaret Todd como un nombre adecuado para diferentes átomos que pertenecen al mismo elemento. JJ Thomson creó una técnica para la separación de isótopos a través de su trabajo en gases ionizados, que posteriormente condujo al descubrimiento de isótopos estables.
Modelo de Bohr
En 1913, el físico Niels Bohr propuso un modelo en el que se suponía que los electrones de un átomo orbitaban el núcleo pero solo podían hacerlo en un conjunto finito de órbitas, y podían saltar entre estas órbitas solo en discretos cambios de energía correspondientes a absorción o radiación de un fotón. Esta cuantificación se usó para explicar por qué las órbitas de los electrones son estables (dado que normalmente, las cargas en aceleración, incluido el movimiento circular, pierden energía cinética emitida como radiación electromagnética, ver radiación sincrotrón ) y por qué los elementos absorben y emiten radiación electromagnética en espectros discretos .
Más tarde en el mismo año, Henry Moseley proporcionó evidencia experimental adicional a favor de la teoría de Niels Bohr. Estos resultados refinaron el modelo de Ernest Rutherford y Antonius Van den Broek, que proponía que el átomo contiene en su núcleo una cantidad de cargas nucleares positivas que es igual a su número (atómico) en la tabla periódica. Hasta estos experimentos, no se sabía que el número atómico fuera una cantidad física y experimental. Que es igual a la carga nuclear atómica sigue siendo el modelo atómico aceptado en la actualidad.
Enlace químico explicado
Los enlaces químicos entre átomos ahora fueron explicados, por Gilbert Newton Lewis en 1916, como las interacciones entre sus electrones constituyentes. Como se sabía que las propiedades químicas de los elementos se repetían en gran medida de acuerdo con la ley periódica, en 1919 el químico estadounidense Irving Langmuir sugirió que esto podría explicarse si los electrones en un átomo estaban conectados o agrupados de alguna manera. Se pensó que los grupos de electrones ocupaban un conjunto de capas de electrones alrededor del núcleo.
Desarrollos adicionales en física cuántica
El experimento de Stern-Gerlach de 1922 proporcionó más evidencia de la naturaleza cuántica de las propiedades atómicas. Cuando un rayo de átomos de plata pasó a través de un campo magnético de forma especial, el rayo se dividió de una manera correlacionada con la dirección del momento angular de un átomo, o giro. Como esta dirección de giro es inicialmente aleatoria, se esperaría que el rayo se desviara en una dirección aleatoria. En cambio, el haz se dividió en dos componentes direccionales, que corresponden al giro atómico orientado hacia arriba o hacia abajo con respecto al campo magnético.
En 1925 Werner Heisenberg publicó la primera formulación matemática consistente de la mecánica cuántica (Matrix Mechanics). Un año antes, en 1924, Louis de Broglie había propuesto que todas las partículas se comportaran en la misma medida que las ondas y, en 1926, Erwin Schrödinger utilizó esta idea para desarrollar un modelo matemático del átomo (Mecánica de la ola) que describió los electrones como tres formas de onda dimensionales en lugar de partículas puntuales.
Una consecuencia del uso de formas de onda para describir partículas es que es matemáticamente imposible obtener valores precisos para la posición y el momento de una partícula en un punto dado en el tiempo; esto se conoció como el principio de incertidumbre, formulado por Werner Heisenberg en 1927. En este concepto, para una precisión dada en la medición de una posición, uno solo podría obtener un rango de valores probables para el impulso, y viceversa. Este modelo fue capaz de explicar observaciones de comportamiento atómico que los modelos anteriores no pudieron, como ciertos patrones estructurales y espectrales de átomos más grandes que el hidrógeno. Por lo tanto, el modelo planetario del átomo se descartó en favor de uno que describía zonas orbitales atómicas alrededor del núcleo donde es más probable que se observe un electrón dado.
Descubrimiento del neutrón
El desarrollo del espectrómetro de masas permitió que la masa de átomos se midiera con mayor precisión. El dispositivo usa un imán para doblar la trayectoria de un haz de iones, y la cantidad de deflexión está determinada por la relación entre la masa de un átomo y su carga. El químico Francis William Aston usó este instrumento para mostrar que los isótopos tenían diferentes masas. La masa atómica de estos isótopos varía en cantidades enteras, llamada regla de número entero. La explicación de estos diferentes isótopos aguardaba el descubrimiento del neutrón, una partícula sin carga con una masa similar al protón, por el físico James Chadwick en 1932. Los isótopos se explicaron entonces como elementos con el mismo número de protones, pero diferentes números de neutrones. dentro del núcleo.
Fisión, física de alta energía y materia condensada
En 1938, el químico alemán Otto Hahn, un estudiante de Rutherford, dirigió neutrones a átomos de uranio que esperaban obtener elementos transuránicos. En cambio, sus experimentos químicos mostraron el bario como un producto. Un año después, Lise Meitner y su sobrino Otto Frisch verificaron que el resultado de Hahn fue la primera fisión nuclear experimental . En 1944, Hahn recibió el Premio Nobel de Química. A pesar de los esfuerzos de Hahn, las contribuciones de Meitner y Frisch no fueron reconocidas.
En la década de 1950, el desarrollo de aceleradores de partículas mejorados y detectores de partículas permitió a los científicos estudiar los impactos de los átomos que se mueven a altas energías. Se descubrió que los neutrones y los protones eran hadrones o compuestos de partículas más pequeñas llamadas quarks. Se desarrolló el modelo estándar de física de partículas que hasta ahora ha explicado con éxito las propiedades del núcleo en términos de estas partículas subatómicas y las fuerzas que gobiernan sus interacciones.
Estructura
Partículas subatómicas
Aunque la palabra átomo originalmente denotó una partícula que no se puede cortar en partículas más pequeñas, en el uso científico moderno el átomo se compone de varias partículas subatómicas. Las partículas constituyentes de un átomo son el electrón, el protón y el neutrón; los tres son fermiones. Sin embargo, el átomo de hidrógeno-1 no tiene neutrones y el ion hidrón no tiene electrones.
El electrón es con mucho la menos masiva de estas partículas con 9.11 × 10 kg , con una carga eléctrica negativa y un tamaño que es demasiado pequeño para ser medido usando las técnicas disponibles. Era la partícula más ligera con una masa de reposo positiva medida, hasta el descubrimiento de la masa de neutrinos. En condiciones normales, los electrones se unen al núcleo cargado positivamente por la atracción creada por cargas eléctricas opuestas. Si un átomo tiene más o menos electrones que su número atómico, entonces se convierte respectivamente negativamente o positivamente cargado como un todo; un átomo cargado se llama ion. Los electrones se conocen desde finales del siglo XIX, principalmente gracias a JJ Thomson; ver la historia de la física subatómica para más detalles.
Los protones tienen una carga positiva y una masa 1.836 veces mayor que la del electrón, a 1.6726 × 10 kg . La cantidad de protones en un átomo se llama su número atómico. Ernest Rutherford (1919) observó que el nitrógeno bajo el bombardeo de partículas alfa expulsa lo que parecen ser núcleos de hidrógeno. En 1920 había aceptado que el núcleo de hidrógeno es una partícula distinta dentro del átomo y lo llamó protón.
Los neutrones no tienen carga eléctrica y tienen una masa libre de 1.839 veces la masa del electrón, o 1.6929 × 10 kg , la más pesada de las tres partículas constituyentes, pero puede reducirse mediante la energía de enlace nuclear. Los neutrones y los protones (conocidos colectivamente como nucleones) tienen dimensiones comparables, del orden de 2.5 × 10 m, aunque la "superficie" de estas partículas no está claramente definida. El neutrón fue descubierto en 1932 por el físico inglés James Chadwick.
Los quarks se mantienen unidos por la fuerte interacción (o fuerza fuerte), que está mediada por gluones. Los protones y neutrones, a su vez, se mantienen unidos entre sí en el núcleo por la fuerza nuclear, que es un residuo de la fuerza fuerte que tiene propiedades de rango algo diferentes (ver el artículo sobre la fuerza nuclear para más). El gluón es un miembro de la familia de bosones gauge, que son partículas elementales que median las fuerzas físicas.
Núcleo
Todos los protones y neutrones enlazados en un átomo forman un pequeño núcleo atómico, y colectivamente se llaman nucleones. El radio de un núcleo es aproximadamente igual a 1.07 3 √ A fm, donde A es el número total de nucleones. Esto es mucho más pequeño que el radio del átomo, que es del orden de 10 fm. Los nucleones están unidos por un potencial atractivo de corto alcance llamado la fuerza fuerte residual. A distancias menores de 2.5 fm, esta fuerza es mucho más poderosa que la fuerza electrostática que provoca que los protones cargados positivamente se repelan entre sí.
Los átomos del mismo elemento tienen la misma cantidad de protones, llamado número atómico. Dentro de un solo elemento, la cantidad de neutrones puede variar, determinando el isótopo de ese elemento. El número total de protones y neutrones determina el núclido. El número de neutrones relativos a los protones determina la estabilidad del núcleo, con ciertos isótopos sometidos a descomposición radiactiva.
El protón, el electrón y el neutrón se clasifican como fermiones. Los fermiones obedecen el principio de exclusión de Pauli que prohíbe fermiones idénticos , como protones múltiples, de ocupar el mismo estado cuántico al mismo tiempo. Por lo tanto, cada protón en el núcleo debe ocupar un estado cuántico diferente de todos los demás protones, y lo mismo se aplica a todos los neutrones del núcleo y a todos los electrones de la nube de electrones. Sin embargo, un protón y un neutrón pueden ocupar el mismo estado cuántico.
Para los átomos con números atómicos bajos, un núcleo que tiene más neutrones que protones tiende a caer a un estado de energía más bajo a través de la desintegración radiactiva, de modo que la relación neutrón-protón está más cerca de uno. Sin embargo, a medida que aumenta el número atómico, se requiere una mayor proporción de neutrones para compensar la repulsión mutua de los protones. Por lo tanto, no hay núcleos estables con el mismo número de protones y neutrones por encima del número atómico Z = 20 (calcio) y a medida que Z aumenta, aumenta la relación neutrones-protones de los isótopos estables. El isótopo estable con la relación protón-neutrón más alta es el plomo-208 (aproximadamente 1,5).
El número de protones y neutrones en el núcleo atómico puede modificarse, aunque esto puede requerir energías muy altas debido a la fuerza fuerte. La fusión nuclear ocurre cuando múltiples partículas atómicas se unen para formar un núcleo más pesado, como a través de la colisión energética de dos núcleos. Por ejemplo, en el núcleo del Sol, los protones requieren energías de 3-10 keV para superar su repulsión mutua -la barrera del culombio- y fusionarse en un solo núcleo. La fisión nuclear es el proceso opuesto, que hace que un núcleo se divida en dos núcleos más pequeños, generalmente a través de la desintegración radiactiva. El núcleo también puede modificarse a través del bombardeo de partículas o fotones subatómicos de alta energía. Si esto modifica el número de protones en un núcleo, el átomo cambia a un elemento químico diferente.
Si la masa del núcleo después de una reacción de fusión es menor que la suma de las masas de las partículas separadas, entonces la diferencia entre estos dos valores se puede emitir como un tipo de energía utilizable (como un rayo gamma o la energía cinética). de una partícula beta), según lo descrito por la fórmula de equivalencia de masa-energía de Albert Einstein, E = mc , donde m es la pérdida de masa y c es la velocidad de la luz. Este déficit es parte de la energía de enlace del nuevo núcleo, y es la pérdida irrecuperable de la energía lo que hace que las partículas fusionadas permanezcan juntas en un estado que requiere que esta energía se separe.
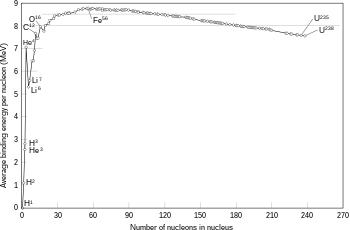
La fusión de dos núcleos que crean núcleos más grandes con números atómicos más bajos que el hierro y el níquel, un número total de nucleones de aproximadamente 60, suele ser un proceso exotérmico que libera más energía de la necesaria para unirlos. Es este proceso de liberación de energía el que hace que la fusión nuclear en las estrellas sea una reacción autosostenida. Para núcleos más pesados, la energía de enlace por nucleón en el núcleo comienza a disminuir. Eso significa que los procesos de fusión que producen núcleos que tienen números atómicos superiores a aproximadamente 26, y las masas atómicas superiores a aproximadamente 60, es un proceso endotérmico. Estos núcleos más masivos no pueden experimentar una reacción de fusión productora de energía que pueda sostener el equilibrio hidrostático de una estrella.
Nube de electrones
Los electrones en un átomo son atraídos por los protones en el núcleo por la fuerza electromagnética. Esta fuerza une los electrones dentro de un pozo potencial electrostático que rodea el núcleo más pequeño, lo que significa que se necesita una fuente externa de energía para que el electrón escape. Cuanto más cerca está el electrón del núcleo, mayor es la fuerza de atracción. Por lo tanto, los electrones que se unen cerca del centro del pozo potencial requieren más energía para escapar que los que están en mayores separaciones.
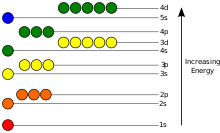
Los electrones, como otras partículas, tienen propiedades de una partícula y una onda. La nube de electrones es una región dentro del pozo potencial donde cada electrón forma un tipo de onda estacionaria tridimensional, una forma de onda que no se mueve en relación con el núcleo. Este comportamiento se define por un orbital atómico, una función matemática que caracteriza la probabilidad de que un electrón parezca estar en una ubicación particular cuando se mide su posición. Solo existe un conjunto discreto (o cuantificado) de estos orbitales alrededor del núcleo, ya que otros patrones de onda posibles decaen rápidamente en una forma más estable. Los orbitales pueden tener una o más estructuras de anillo o nodo, y difieren entre sí en tamaño, forma y orientación.
Cómo se construyen los átomos a partir de orbitales de electrones y enlace a la tabla periódica
Cada orbital atómico corresponde a un nivel de energía particular del electrón. El electrón puede cambiar su estado a un nivel de energía más alto al absorber un fotón con energía suficiente para impulsarlo al nuevo estado cuántico. Del mismo modo, a través de la emisión espontánea, un electrón en un estado de energía superior puede caer a un estado de energía inferior mientras irradia el exceso de energía como un fotón. Estos valores de energía característicos, definidos por las diferencias en las energías de los estados cuánticos, son responsables de las líneas espectrales atómicas.
La cantidad de energía necesaria para eliminar o agregar un electrón -la energía de enlace del electrón- es mucho menor que la energía de enlace de los nucleones. Por ejemplo, requiere solo 13,6 eV para extraer un electrón de estado fundamental de un átomo de hidrógeno, en comparación con 2,23 millones de eV para dividir un núcleo de deuterio. Los átomos son eléctricamente neutros si tienen el mismo número de protones y electrones. Los átomos que tienen un déficit o un exceso de electrones se llaman iones. Los electrones que están más alejados del núcleo pueden transferirse a otros átomos cercanos o compartirse entre átomos. Mediante este mecanismo, los átomos pueden unirse a moléculas y otros tipos de compuestos químicos, como cristales de redes iónicas y covalentes.
Propiedades
Propiedades nucleares
Por definición, dos átomos con un número idéntico de protones en sus núcleos pertenecen al mismo elemento químico. Los átomos con igual número de protones pero con un número diferente de neutrones son isótopos diferentes del mismo elemento. Por ejemplo, todos los átomos de hidrógeno admiten exactamente un protón, pero existen isótopos sin neutrones (hidrógeno-1, con diferencia la forma más común, también llamada protium), un neutrón (deuterio), dos neutrones (tritio) y más de dos neutrones . Los elementos conocidos forman un conjunto de números atómicos, desde el elemento de protón simple hidrógeno hasta el elemento de protones 118 oganesson. Todos los isótopos conocidos de elementos con números atómicos superiores a 82 son radioactivos, aunque la radiactividad del elemento 83 (bismuto) es tan pequeña que es prácticamente despreciable.
Aproximadamente 339 nucleidos ocurren naturalmente en la Tierra, de los cuales 254 (aproximadamente el 75%) no se han observado que se descompongan, y se conocen como "isótopos estables". Sin embargo, solo 90 de estos núclidos son estables a todas las descomposiciones, incluso en teoría. No se observó que decayera otro 164 (con un total de 254), aunque en teoría es energéticamente posible. Estos también se clasifican formalmente como "estables". Un adicional de 34 nucleidos radiactivos tienen semividas de más de 80 millones de años, y son lo suficientemente longevos como para estar presentes desde el nacimiento del sistema solar. Esta colección de 288 nucleidos se conoce como núclidos primordiales. Finalmente, se conocen otros 51 nucleidos efímeros que se producen de forma natural, como productos secundarios de la descomposición de nucleidos primordiales (como el radio del uranio) o como productos de procesos energéticos naturales en la Tierra,
Para 80 de los elementos químicos, existe al menos un isótopo estable. Como regla general, solo hay un puñado de isótopos estables para cada uno de estos elementos, con un promedio de 3.2 isótopos estables por elemento. Veintiséis elementos tienen un solo isótopo estable, mientras que la mayor cantidad de isótopos estables observados para cualquier elemento es diez, para el elemento estaño. Los elementos 43, 61 y todos los elementos numerados con 83 o más no tienen isótopos estables.
La estabilidad de los isótopos se ve afectada por la relación de protones a neutrones, y también por la presencia de ciertos "números mágicos" de neutrones o protones que representan capas cuánticas cerradas y llenas. Estas capas cuánticas corresponden a un conjunto de niveles de energía dentro del modelo de caparazón del núcleo; las conchas llenas, como la capa llena de 50 protones para estaño, confieren una estabilidad inusual en el núclido. De los 254 núclidos estables conocidos, solo cuatro tienen un número impar de protones y número impar de neutrones: hidrógeno-2 (deuterio), litio-6, boro-10 y nitrógeno-14. Además, solo cuatro nucleidos impares radioactivos de ocurrencia natural tienen una vida media de más de mil millones de años: potasio-40, vanadio-50, lantano-138 y tantalio-180m. La mayoría de los núcleos impares son altamente inestables con respecto a la desintegración beta, porque los productos de desintegración son uniformes y, por lo tanto, están más unidos, debido a los efectos de apareamiento nuclear.
Masa
La gran mayoría de la masa de un átomo proviene de los protones y neutrones que lo componen. El número total de estas partículas (llamadas "nucleones") en un átomo dado se llama número de masa. Es un número entero positivo y adimensional (en lugar de tener una dimensión de masa), porque expresa un recuento. Un ejemplo de uso de un número de masa es "carbono-12", que tiene 12 nucleones (seis protones y seis neutrones).
La masa real de un átomo en reposo a menudo se expresa utilizando la unidad de masa atómica unificada (u), también llamada dalton (Da). Esta unidad se define como la duodécima parte de la masa de un átomo neutro libre de carbono-12, que es aproximadamente de 1,66 × 10 kg . El hidrógeno-1 (el isótopo más ligero del hidrógeno, que es también el núclido con la masa más baja) tiene un peso atómico de 1.007825 u. El valor de este número se denomina masa atómica. Un átomo dado tiene una masa atómica aproximadamente igual (dentro de 1%) a su número de masa multiplicado por la unidad de masa atómica (por ejemplo, la masa de un nitrógeno-14 es aproximadamente 14 u). Sin embargo, este número no será exactamente un número entero, excepto en el caso del carbono 12 (ver más abajo). El átomo estable más pesado es el lead-208, con una masa de 207,976 6521 u.
Como incluso los átomos más masivos son demasiado livianos para trabajar directamente, los químicos usan la unidad de moles. Una mole de átomos de cualquier elemento siempre tiene la misma cantidad de átomos (alrededor de
6.022
× 10 ). Este número se eligió de modo que si un elemento tiene una masa atómica de 1 u, una mole de átomos de ese elemento tiene una masa cercana a un gramo. Debido a la definición de la unidad de masa atómica unificada, cada átomo de carbono 12 tiene una masa atómica de exactamente 12 u, por lo que una mole de átomos de carbono 12 pesa exactamente 0,012 kg.
6.022
× 10 ). Este número se eligió de modo que si un elemento tiene una masa atómica de 1 u, una mole de átomos de ese elemento tiene una masa cercana a un gramo. Debido a la definición de la unidad de masa atómica unificada, cada átomo de carbono 12 tiene una masa atómica de exactamente 12 u, por lo que una mole de átomos de carbono 12 pesa exactamente 0,012 kg.
Forma y tamaño
Los átomos carecen de un límite exterior bien definido, por lo que sus dimensiones se describen generalmente en términos de un radio atómico. Esta es una medida de la distancia a la cual la nube de electrones se extiende desde el núcleo. Sin embargo, esto supone que el átomo exhibe una forma esférica, que solo se obedece para átomos en vacío o espacio libre. Los radios atómicos pueden derivarse de las distancias entre dos núcleos cuando los dos átomos se unen en un enlace químico. El radio varía con la ubicación de un átomo en el gráfico atómico, el tipo de enlace químico, el número de átomos vecinos (número de coordinación) y una propiedad mecánica cuántica conocida como spin. En la tabla periódica de los elementos, el tamaño del átomo tiende a aumentar al moverse hacia abajo en las columnas, pero disminuye cuando se mueve entre las filas (de izquierda a derecha). En consecuencia, el átomo más pequeño es helio con un radio de 32 p. M.,
Cuando se somete a fuerzas externas, como campos eléctricos, la forma de un átomo puede desviarse de la simetría esférica. La deformación depende de la magnitud del campo y del tipo orbital de los electrones de la cubierta exterior, como se muestra por consideraciones teóricas de grupo. Las desviaciones asféricas pueden ser provocadas, por ejemplo, en cristales, donde pueden ocurrir grandes campos de cristal eléctrico en sitios de red de baja simetría. Se ha demostrado que ocurren deformaciones elipsoidales significativas para iones de azufre e iones de calcógeno en compuestos de tipo pirita.
Las dimensiones atómicas son miles de veces más pequeñas que las longitudes de onda de la luz (400-700 nm) por lo que no se pueden ver con un microscopio óptico. Sin embargo, se pueden observar átomos individuales usando un microscopio de efecto túnel. Para visualizar la pequeñez del átomo, considere que un cabello humano típico tiene aproximadamente 1 millón de átomos de carbono de ancho. Una sola gota de agua contiene aproximadamente 2 sextillones ( 2 × 10 ) átomos de oxígeno y el doble de átomos de hidrógeno. Un diamante de un solo quilate con una masa de 2 × 10 kg contiene aproximadamente 10 sextillones (10) átomos de carbono. Si una manzana se ampliara al tamaño de la Tierra, entonces los átomos en la manzana serían aproximadamente del tamaño de la manzana original.
Desintegración radioactiva
Cada elemento tiene uno o más isótopos que tienen núcleos inestables que están sujetos a la desintegración radiactiva, lo que hace que el núcleo emita partículas o radiación electromagnética. La radioactividad puede ocurrir cuando el radio de un núcleo es grande en comparación con el radio de la fuerza fuerte, que solo actúa sobre distancias del orden de 1 fm.
Las formas más comunes de descomposición radiactiva son:
- Desintegración alfa: este proceso se produce cuando el núcleo emite una partícula alfa, que es un núcleo de helio formado por dos protones y dos neutrones. El resultado de la emisión es un nuevo elemento con un número atómico menor.
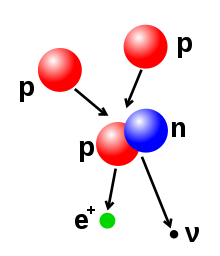
- Descomposición beta (y captura de electrones): estos procesos están regulados por la fuerza débil, y son el resultado de una transformación de un neutrón en un protón, o un protón en un neutrón. La transición de neutrón a protón se acompaña de la emisión de un electrón y un antineutrino, mientras que la transición de protón a neutrón (excepto en la captura de electrones) causa la emisión de un positrón y un neutrino. Las emisiones de electrones o positrones se llaman partículas beta. La descomposición beta aumenta o disminuye el número atómico del núcleo en uno. La captura de electrones es más común que la emisión de positrones, ya que requiere menos energía. En este tipo de descomposición, un electrón es absorbido por el núcleo, en lugar de un positrón emitido por el núcleo. Todavía se emite un neutrino en este proceso, y un protón cambia a un neutrón.
- Desintegración gamma: este proceso es el resultado de un cambio en el nivel de energía del núcleo a un estado inferior, lo que resulta en la emisión de radiación electromagnética. El estado excitado de un núcleo que da como resultado la emisión gamma ocurre generalmente después de la emisión de una partícula alfa o beta. Por lo tanto, la desintegración gamma generalmente sigue a la desintegración alfa o beta.
Otros tipos más raros de desintegración radiactiva incluyen la eyección de neutrones o protones o grupos de nucleones de un núcleo, o más de una partícula beta. Un análogo de emisión gamma que permite a los núcleos excitados perder energía de una manera diferente, es la conversión interna, un proceso que produce electrones de alta velocidad que no son rayos beta, seguido de la producción de fotones de alta energía que no son rayos gamma. Unos pocos núcleos grandes explotan en dos o más fragmentos cargados de masas variables más varios neutrones, en una descomposición llamada fisión nuclear espontánea.
Cada isótopo radiactivo tiene un período de tiempo de desintegración característico, la vida media, que está determinado por la cantidad de tiempo necesario para que la mitad de la muestra se descomponga. Este es un proceso de decaimiento exponencial que disminuye constantemente la proporción del isótopo restante en un 50% en cada vida media. Por lo tanto, después de que hayan transcurrido dos vidas medias, solo está presente el 25% del isótopo, y así sucesivamente.
Momento magnético
Las partículas elementales poseen una propiedad mecánica cuántica intrínseca conocida como spin. Esto es análogo al momento angular de un objeto que gira alrededor de su centro de masa, aunque estrictamente hablando, se cree que estas partículas son puntuales y no se puede decir que giran. El giro se mide en unidades de la constante de Planck reducida (ħ), y todos los electrones, protones y neutrones tienen spin ½ ħ o "spin-½". En un átomo, los electrones en movimiento alrededor del núcleo poseen un momento angular orbital además de su giro, mientras que el núcleo mismo posee un momento angular debido a su giro nuclear.
El campo magnético producido por un átomo, su momento magnético, está determinado por estas diversas formas de momento angular, del mismo modo que un objeto cargado en rotación genera clásicamente un campo magnético. Sin embargo, la contribución más dominante proviene de spin electrónico. Debido a la naturaleza de los electrones para obedecer el principio de exclusión de Pauli, en el que no se pueden encontrar dos electrones en el mismo estado cuántico, los electrones unidos se emparejan entre sí, con un miembro de cada par en un estado de giro y el otro en el opuesto, estado de giro hacia abajo. Por lo tanto, estos giros se cancelan mutuamente, reduciendo el momento dipolar magnético total a cero en algunos átomos con un número par de electrones.
En elementos ferromagnéticos como el hierro, el cobalto y el níquel, un número impar de electrones conduce a un electrón no apareado y a un momento magnético general neto. Los orbitales de los átomos vecinos se superponen y se obtiene un estado de energía más bajo cuando los giros de los electrones desapareados se alinean entre sí, un proceso espontáneo conocido como interacción de intercambio. Cuando los momentos magnéticos de los átomos ferromagnéticos se alinean, el material puede producir un campo macroscópico medible. Los materiales paramagnéticos tienen átomos con momentos magnéticos que se alinean en direcciones aleatorias cuando no hay un campo magnético presente, pero los momentos magnéticos de los átomos individuales se alinean en presencia de un campo.
El núcleo de un átomo no tendrá spin cuando tenga números pares de neutrones y protones, pero para otros casos de números impares, el núcleo puede tener spin. Normalmente, los núcleos con espín están alineados en direcciones aleatorias debido al equilibrio térmico. Sin embargo, para ciertos elementos (como el xenón-129) es posible polarizar una proporción significativa de los estados de espín nuclear para que estén alineados en la misma dirección, una condición llamada hiperpolarización. Esto tiene aplicaciones importantes en la proyección de imagen de resonancia magnética.
Niveles de energía
La energía potencial de un electrón en un átomo es negativa, su dependencia de su posición alcanza el mínimo (el valor más absoluto) dentro del núcleo, y desaparece cuando la distancia desde el núcleo va al infinito, aproximadamente en una proporción inversa a la distancia . En el modelo cuántico-mecánico, un electrón ligado solo puede ocupar un conjunto de estados centrados en el núcleo, y cada estado corresponde a un nivel de energía específico; ver la ecuación de Schrödinger independiente del tiempo para la explicación teórica. Un nivel de energía puede medirse por la cantidad de energía necesaria para desenlazar el electrón del átomo, y por lo general se da en unidades de electronvoltios (eV). El estado de energía más bajo de un electrón ligado se denomina estado fundamental, es decir, estado estacionario, mientras que una transición de electrones a un nivel superior da como resultado un estado excitado. El electrón ' n aumenta porque la distancia (promedio) al núcleo aumenta. La dependencia de la energía en ℓ no está causada por el potencial electrostático del núcleo, sino por la interacción entre los electrones.
Para que un electrón transite entre dos estados diferentes, por ejemplo, estado conectado a tierra al primer nivel excitado (ionización), debe absorber o emitir un fotón con una energía que coincida con la diferencia en la energía potencial de esos niveles, según el modelo de Niels Bohr. ser calculado con precisión por la ecuación de Schrödinger. Los electrones saltan entre orbitales en forma de partículas. Por ejemplo, si un solo fotón choca con los electrones, solo un electrón cambia los estados en respuesta al fotón; ver propiedades de Electrones.
La energía de un fotón emitido es proporcional a su frecuencia, por lo que estos niveles de energía específicos aparecen como bandas distintas en el espectro electromagnético. Cada elemento tiene un espectro característico que puede depender de la carga nuclear, subcapas llenas de electrones, las interacciones electromagnéticas entre los electrones y otros factores.
Cuando un espectro continuo de energía pasa a través de un gas o plasma, algunos de los fotones son absorbidos por átomos, lo que hace que los electrones cambien su nivel de energía. Aquellos electrones excitados que permanecen unidos a su átomo emiten espontáneamente esta energía como un fotón, viajando en una dirección aleatoria, y así regresan a los niveles de energía más bajos. Por lo tanto, los átomos se comportan como un filtro que forma una serie de bandas de absorción oscuras en la salida de energía. (Un observador que ve los átomos desde una vista que no incluye el espectro continuo en el fondo, en cambio ve una serie de líneas de emisión de los fotones emitidos por los átomos). Las mediciones espectroscópicas de la fuerza y el ancho de las líneas espectrales atómicas permiten la composición y propiedades físicas de una sustancia a determinar.
Un examen detallado de las líneas espectrales revela que algunas muestran una fina división de estructura. Esto ocurre debido al acoplamiento espín-órbita, que es una interacción entre el espín y el movimiento del electrón más externo. Cuando un átomo está en un campo magnético externo, las líneas espectrales se dividen en tres o más componentes; un fenómeno llamado efecto Zeeman. Esto es causado por la interacción del campo magnético con el momento magnético del átomo y sus electrones. Algunos átomos pueden tener múltiples configuraciones de electrones con el mismo nivel de energía, que aparece como una sola línea espectral. La interacción del campo magnético con el átomo cambia estas configuraciones de electrones a niveles de energía ligeramente diferentes, dando como resultado múltiples líneas espectrales.
Si un electrón encuadernado está en un estado excitado, un fotón que interactúa con la energía adecuada puede provocar la emisión estimulada de un fotón con un nivel de energía coincidente. Para que esto ocurra, el electrón debe caer a un estado de energía más bajo que tenga una diferencia de energía que coincida con la energía del fotón que interactúa. El fotón emitido y el fotón interactivo se mueven en paralelo y con fases coincidentes. Es decir, los patrones de onda de los dos fotones están sincronizados. Esta propiedad física se utiliza para fabricar láseres, que pueden emitir un haz coherente de energía de luz en una banda de frecuencia estrecha.
Comportamiento de valencia y vinculación
Valency es el poder de combinación de un elemento. Es igual al número de átomos de hidrógeno que ese átomo puede combinar o desplazar en compuestos formadores. La capa de electrones más externa de un átomo en su estado no combinado se conoce como la capa de valencia, y los electrones en esa capa se llaman electrones de valencia. El número de electrones de valencia determina el comportamiento de unión con otros átomos. Los átomos tienden a reaccionar químicamente entre sí de una manera que llena (o vacía) sus capas exteriores de valencia. Por ejemplo, una transferencia de un solo electrón entre átomos es una aproximación útil para enlaces que se forman entre átomos con un electrón más que una capa llena, y otros que tienen un solo electrón menos que una capa completa, como ocurre en el compuesto cloruro de sodio y otras sales iónicas químicas. Sin embargo, muchos elementos muestran múltiples valencias, o tendencias a compartir diferentes cantidades de electrones en diferentes compuestos. Por lo tanto, los enlaces químicos entre estos elementos toman muchas formas de intercambio de electrones que son más que simples transferencias de electrones. Los ejemplos incluyen el elemento carbono y los compuestos orgánicos.
Los elementos químicos a menudo se muestran en una tabla periódica que se presenta para mostrar las propiedades químicas recurrentes, y los elementos con el mismo número de electrones de valencia forman un grupo que está alineado en la misma columna de la tabla. (Las filas horizontales corresponden al relleno de una capa cuántica de electrones.) Los elementos en el extremo derecho de la tabla tienen su capa exterior completamente llena de electrones, lo que da como resultado elementos químicamente inertes conocidos como gases nobles.
Estados
Las cantidades de átomos se encuentran en diferentes estados de la materia que dependen de las condiciones físicas, como la temperatura y la presión. Al variar las condiciones, los materiales pueden hacer la transición entre sólidos, líquidos, gases y plasmas. Dentro de un estado, un material también puede existir en diferentes alótropos. Un ejemplo de esto es el carbono sólido, que puede existir como grafito o diamante. También existen alotropos gaseosos, como dioxígeno y ozono.
A temperaturas cercanas al cero absoluto, los átomos pueden formar un condensado de Bose-Einstein, en cuyo punto los efectos mecánicos cuánticos, que normalmente solo se observan a escala atómica, se hacen aparentes a escala macroscópica. Esta colección de átomos súper enfriada se comporta como un único súper átomo, lo que puede permitir comprobaciones fundamentales del comportamiento de la mecánica cuántica.
Identificación
El microscopio de túnel de barrido es un dispositivo para ver superficies a nivel atómico. Utiliza el fenómeno de túnel cuántico, que permite que las partículas pasen a través de una barrera que normalmente sería insuperable. Los electrones atraviesan el vacío entre dos electrodos planos de metal, en cada uno de los cuales se encuentra un átomo adsorbido, proporcionando una densidad de corriente de túneles que se puede medir. El escaneo de un átomo (tomado como la punta) a medida que se mueve más allá del otro (la muestra) permite trazar el desplazamiento de la punta en función de la separación lateral para una corriente constante. El cálculo muestra el grado en que las imágenes del microscopio de barrido de un átomo individual son visibles. Confirma que, para un sesgo bajo, el microscopio representa las dimensiones promediadas por el espacio de los orbitales de electrones a través de niveles de energía muy compactos: la densidad de estados local de Fermi.
Un átomo se puede ionizar eliminando uno de sus electrones. La carga eléctrica hace que la trayectoria de un átomo se doble cuando pasa a través de un campo magnético. El radio por el cual la trayectoria de un ion en movimiento es girada por el campo magnético está determinada por la masa del átomo. El espectrómetro de masas utiliza este principio para medir la relación de masa a carga de iones. Si una muestra contiene múltiples isótopos, el espectrómetro de masas puede determinar la proporción de cada isótopo en la muestra midiendo la intensidad de los diferentes haces de iones. Las técnicas para vaporizar átomos incluyen la espectroscopía de emisión atómica de plasma acoplado inductivamente y la espectrometría de masas de plasma acoplado inductivamente, que utilizan un plasma para vaporizar muestras para su análisis.
Un método más selectivo de área es la espectroscopía de pérdida de energía de electrones, que mide la pérdida de energía de un haz de electrones dentro de un microscopio electrónico de transmisión cuando interactúa con una porción de una muestra. El tomógrafo de sonda atómica tiene una resolución subnanométrica en 3-D y puede identificar químicamente átomos individuales utilizando la espectrometría de masas de tiempo de vuelo.
Los espectros de estados excitados se pueden usar para analizar la composición atómica de estrellas distantes. Las longitudes de onda de luz específicas contenidas en la luz observada de las estrellas se pueden separar y relacionar con las transiciones cuantificadas en átomos de gas libres. Estos colores se pueden replicar usando una lámpara de descarga de gas que contiene el mismo elemento. El helio fue descubierto de esta manera en el espectro del Sol 23 años antes de que se encontrara en la Tierra.
Origen y estado actual
Los átomos forman aproximadamente el 4% de la densidad total de energía del Universo observable, con una densidad promedio de aproximadamente 0.25 átomos / m. Dentro de una galaxia como la Vía Láctea, los átomos tienen una concentración mucho más alta, con la densidad de la materia en el medio interestelar (ISM) que varía de 10 a 10 átomos / m. Se cree que el Sol está dentro de la burbuja local, una región de gas altamente ionizado, por lo que la densidad en el vecindario solar es de solo 10 átomos / m. Las estrellas se forman a partir de densas nubes en el ISM, y los procesos evolutivos de las estrellas resultan en el enriquecimiento constante del ISM con elementos más masivos que el hidrógeno y el helio. Hasta el 95% de los átomos de la Vía Láctea se concentran dentro de las estrellas y la masa total de átomos forma aproximadamente el 10% de la masa de la galaxia. (El resto de la masa es una materia oscura desconocida).
Formación
Se cree que los electrones existen en el Universo desde las primeras etapas del Big Bang. Los núcleos atómicos se forman en las reacciones de nucleosíntesis. En unos tres minutos, la nucleosíntesis de Big Bang produjo la mayor parte del helio, el litio y el deuterio en el Universo, y quizás parte del berilio y el boro.
La ubicuidad y estabilidad de los átomos depende de su energía de enlace, lo que significa que un átomo tiene una energía más baja que un sistema no unido del núcleo y los electrones. Donde la temperatura es mucho más alta que el potencial de ionización, la materia existe en forma de plasma, un gas de iones cargados positivamente (posiblemente, núcleos desnudos) y electrones. Cuando la temperatura cae por debajo del potencial de ionización, los átomos se vuelven estadísticamente favorables. Los átomos (completos con electrones enlazados) pasaron a dominar a las partículas cargadas 380,000 años después del Big Bang, una época llamada recombinación, cuando el Universo en expansión se enfría lo suficiente como para permitir que los electrones se adhieran a los núcleos.
Desde el Big Bang, que no produjo carbono ni elementos más pesados, los núcleos atómicos se combinaron en estrellas mediante el proceso de fusión nuclear para producir más helio del elemento y (a través del triple proceso alfa) la secuencia de elementos desde carbono hasta hierro; ver la nucleosíntesis estelar para más detalles.
Los isótopos como el litio-6, así como algo de berilio y boro se generan en el espacio a través de la espalación de los rayos cósmicos. Esto ocurre cuando un protón de alta energía golpea un núcleo atómico, lo que hace que se expulsen grandes cantidades de nucleones.
Los elementos más pesados que el hierro se produjeron en supernovas a través del proceso r y en estrellas AGB a través del proceso s, ambos implican la captura de neutrones por núcleos atómicos. Elementos como el plomo se formaron principalmente a través de la descomposición radiactiva de elementos más pesados.
Tierra
La mayoría de los átomos que componen la Tierra y sus habitantes estaban presentes en su forma actual en la nebulosa que se colapsó de una nube molecular para formar el Sistema Solar. El resto es el resultado de la desintegración radiactiva, y su proporción relativa se puede utilizar para determinar la edad de la Tierra a través de la datación radiométrica. La mayor parte del helio en la corteza de la Tierra (alrededor del 99% del helio de los pozos de gas, como lo muestra su menor abundancia de helio-3) es un producto de la desintegración alfa.
Hay unos pocos átomos de trazas en la Tierra que no estaban presentes al principio (es decir, no "primordiales") ni resultados de descomposición radiactiva. El carbono-14 es generado continuamente por los rayos cósmicos en la atmósfera. Algunos átomos en la Tierra han sido generados artificialmente o como subproductos de reactores nucleares o explosiones. De los elementos transuránicos, aquellos con números atómicos mayores que 92, solo el plutonio y el neptunio ocurren naturalmente en la Tierra. Los elementos transuránicos tienen vidas radiactivas más cortas que la edad actual de la Tierra y, por lo tanto, las cantidades identificables de estos elementos han decaído hace tiempo, con la excepción de las trazas de plutonio-244 posiblemente depositadas por el polvo cósmico. Los depósitos naturales de plutonio y neptunio se producen por captura de neutrones en el mineral de uranio.
La Tierra contiene aproximadamente 1.33 × 10 átomos. Aunque existen pequeños números de átomos independientes de gases nobles, como el argón, el neón y el helio, el 99% de la atmósfera se une en forma de moléculas, incluido el dióxido de carbono y el oxígeno y el nitrógeno diatómico. En la superficie de la Tierra, una abrumadora mayoría de átomos se combinan para formar diversos compuestos, que incluyen agua, sal, silicatos y óxidos. Los átomos también se pueden combinar para crear materiales que no consisten en moléculas discretas, que incluyen cristales y metales líquidos o sólidos. Esta materia atómica forma arreglos en red que carecen del tipo particular de orden interrumpido a pequeña escala asociado con la materia molecular.
Formas raras y teóricas
Elementos superpesados
Mientras que se sabe que los isótopos con números atómicos más altos que el plomo (82) son radiactivos, se ha propuesto una "isla de estabilidad" para algunos elementos con números atómicos por encima de 103. Estos elementos superpesados pueden tener un núcleo relativamente estable contra la desintegración radiactiva. El candidato más probable para un átomo superpesado estable, unbihexium, tiene 126 protones y 184 neutrones.
Materia exótica
Cada partícula de materia tiene una partícula de antimateria correspondiente con la carga eléctrica opuesta. Por lo tanto, el positrón es un antielectrón con carga positiva y el antiprotón es un equivalente con carga negativa de un protón. Cuando una materia y la correspondiente partícula de antimateria se encuentran, se aniquilan entre sí. Debido a esto, junto con un desequilibrio entre el número de partículas de materia y antimateria, estas últimas son raras en el universo. Las primeras causas de este desequilibrio aún no se comprenden por completo, aunque las teorías de la bariogénesis pueden ofrecer una explicación. Como resultado, no se han descubierto átomos de antimateria en la naturaleza. Sin embargo, en 1996, la contrapartida antimateria del átomo de hidrógeno (antihidrógeno) se sintetizó en el laboratorio CERN en Ginebra.
Se han creado otros átomos exóticos al reemplazar uno de los protones, neutrones o electrones con otras partículas que tienen la misma carga. Por ejemplo, un electrón puede ser reemplazado por un muón más masivo, formando un átomo muónico. Estos tipos de átomos se pueden usar para probar las predicciones fundamentales de la física.
Obtenido de: https://en.wikipedia.org/wiki/Atom