Catálisis
Definición
Catálisis ( / k ə t æ l ɪ s ɪ s / ) es el aumento en la velocidad de una reacción química debido a la participación de una sustancia adicional se llama un catalizador ( / k æ t əl ɪ s t / ), que no se consume en la reacción catalizada y puede continuar actuando repetidamente. A menudo, solo se requieren pequeñas cantidades de catalizador en principio.
En general, las reacciones ocurren más rápido con un catalizador porque requieren menos energía de activación. En los mecanismos catalizados, el catalizador generalmente reacciona para formar un intermediario temporal que luego regenera el catalizador original en un proceso cíclico.
Los catalizadores pueden clasificarse como homogéneos o heterogéneos. Un catalizador homogéneo es aquel cuyas moléculas están dispersas en la misma fase (generalmente gaseosa o líquida) como moléculas reactivas. Un catalizador heterogéneo es aquel cuyas moléculas no están en la misma fase que los reactivos, que típicamente son gases o líquidos que se adsorben en la superficie del catalizador sólido. Las enzimas y otros biocatalizadores a menudo se consideran como una tercera categoría.
Perspectiva técnica
En presencia de un catalizador, se requiere menos energía libre para alcanzar el estado de transición, pero la energía libre total de los reactivos para los productos no cambia. Un catalizador puede participar en múltiples transformaciones químicas. El efecto de un catalizador puede variar debido a la presencia de otras sustancias conocidas como inhibidores o venenos (que reducen la actividad catalítica) o promotores (que aumentan la actividad y también afectan la temperatura de la reacción).
Las reacciones catalizadas tienen una energía de activación más baja (energía libre de activación que limita la velocidad) que la reacción no catalizada correspondiente, dando como resultado una velocidad de reacción más alta a la misma temperatura y para las mismas concentraciones de reactivo. Sin embargo, la mecánica detallada de la catálisis es compleja. Los catalizadores pueden afectar favorablemente al ambiente de reacción (como calor) o unirse a los reactivos para polarizar enlaces, por ejemplo, catalizadores ácidos para reacciones de compuestos de carbonilo, o formar intermedios específicos que no se producen naturalmente, como ésteres de osmate en dihidroxilación catalizada por tetróxido de osmio de alquenos, o causar la disociación de reactivos a formas reactivas, tales como hidrógeno quimiosorbente en la hidrogenación catalítica.
Cinéticamente, las reacciones catalíticas son reacciones químicas típicas; es decir, la velocidad de reacción depende de la frecuencia de contacto de los reactivos en la etapa de determinación de velocidad. Normalmente, el catalizador participa en este paso más lento, y las velocidades están limitadas por la cantidad de catalizador y su "actividad". En catálisis heterogénea, la difusión de reactivos a la superficie y la difusión de productos desde la superficie puede ser determinante de la velocidad. Un catalizador basado en nanomaterial es un ejemplo de un catalizador heterogéneo. Eventos análogos asociados con la unión del sustrato y la disociación del producto se aplican a catalizadores homogéneos.
Aunque los catalizadores no son consumidos por la reacción en sí, pueden ser inhibidos, desactivados o destruidos por procesos secundarios. En la catálisis heterogénea, los procesos secundarios típicos incluyen la coquización donde el catalizador queda cubierto por productos secundarios poliméricos. Además, los catalizadores heterogéneos pueden disolverse en la solución en un sistema sólido-líquido o sublimarse en un sistema de gas sólido.
Fondo
La producción de la mayoría de los productos químicos de importancia industrial implica catálisis. Del mismo modo, la mayoría de los procesos bioquímicamente significativos son catalizados. La investigación en catálisis es un campo importante en la ciencia aplicada e involucra muchas áreas de la química, especialmente la química organometálica y la ciencia de los materiales. La catálisis es relevante para muchos aspectos de la ciencia ambiental, por ejemplo, el convertidor catalítico en automóviles y la dinámica del agujero de ozono. Las reacciones catalíticas se prefieren en la química verde respetuosa con el medio ambiente debido a la cantidad reducida de residuos generados, en oposición a las reacciones estequiométricas en las que se consumen todos los reactivos y se forman más productos secundarios. Muchos metales de transición y complejos de metales de transición se usan también en catálisis. Los catalizadores llamados enzimas son importantes en biología.
Un catalizador funciona proporcionando una ruta de reacción alternativa al producto de reacción. La velocidad de la reacción se incrementa ya que esta ruta alternativa tiene una energía de activación más baja que la ruta de reacción no mediada por el catalizador. La desproporción del peróxido de hidrógeno crea agua y oxígeno, como se muestra a continuación.
- 2 H 2 O 2 → 2 H 2 O + O 2
Esta reacción es preferible en el sentido de que los productos de reacción son más estables que el material de partida, aunque la reacción no catalizada es lenta. De hecho, la descomposición del peróxido de hidrógeno es tan lenta que las soluciones de peróxido de hidrógeno están disponibles comercialmente. Esta reacción se ve fuertemente afectada por catalizadores como el dióxido de manganeso o la enzima peroxidasa en organismos. Al agregar una pequeña cantidad de dióxido de manganeso, el peróxido de hidrógeno reacciona rápidamente. Este efecto se ve fácilmente por la efervescencia del oxígeno. El dióxido de manganeso no se consume en la reacción y, por lo tanto, puede recuperarse sin cambios y reutilizarse indefinidamente. En consecuencia, el dióxido de manganeso cataliza esta reacción.
Principios generales
Unidades
La actividad catalítica usualmente se denota con el símbolo z y se mide en mol / s, una unidad que se llamó katal y definió la unidad SI para actividad catalítica desde 1999. La actividad catalítica no es un tipo de velocidad de reacción, sino una propiedad del catalizador bajo ciertas condiciones, en relación con una reacción química específica. La actividad catalítica de un katal (Símbolo 1 kat = 1 mol / s) de un catalizador significa que un mol de ese catalizador (sustancia, en Mol) catalizará 1 mol del reactivo al producto en un segundo. Un catalizador puede tener, y generalmente tendrá, actividad catalítica diferente para reacciones distintas. Vea katal para un ejemplo.
Existen otras unidades SI derivadas relacionadas con la actividad catalítica, ver la referencia anterior para más detalles.
Mecanismo típico
Los catalizadores generalmente reaccionan con uno o más reactivos para formar intermedios que posteriormente dan el producto de reacción final, en el proceso de regeneración del catalizador. El siguiente es un esquema de reacción típico, donde C representa el catalizador, X e Y son reactivos, y Z es el producto de la reacción de X e Y:
- X + C → X C( 1 )
- Y + X C → XY C( 2 )
- XY C → C Z( 3 )
- C Z → C + Z( 4 )
Aunque el catalizador es consumido por la reacción 1 , posteriormente es producido por la reacción 4 , por lo que no ocurre en la ecuación de reacción global:
- X + Y → Z
Como un catalizador se regenera en una reacción, a menudo solo se necesitan pequeñas cantidades para aumentar la velocidad de la reacción. En la práctica, sin embargo, los catalizadores a veces se consumen en procesos secundarios.
El catalizador generalmente aparece en la ecuación de velocidad. Por ejemplo, si el paso de determinación de velocidad en el esquema de reacción anterior es el primer paso
X + C → XC, la reacción catalizada será de segundo orden con la ecuación de velocidad v = k cat [X] [C], que es proporcional al concentración de catalizador [C]. Sin embargo, [C] permanece constante durante la reacción de modo que la reacción catalizada es de pseudo primer orden: v = k obs [X], donde k obs = k cat [C].
X + C → XC, la reacción catalizada será de segundo orden con la ecuación de velocidad v = k cat [X] [C], que es proporcional al concentración de catalizador [C]. Sin embargo, [C] permanece constante durante la reacción de modo que la reacción catalizada es de pseudo primer orden: v = k obs [X], donde k obs = k cat [C].
Como un ejemplo de un mecanismo detallado a nivel microscópico, en 2008 los investigadores daneses primero revelado la secuencia de eventos cuando el oxígeno y el hidrógeno se combinan en la superficie de dióxido de titanio (TiO 2 , o titania ) para producir agua. Con una serie de lapso de tiempo de imágenes de microscopía de efecto túnel de barrido, determinaron que las moléculas experimentan adsorción, disociación y difusión antes de reaccionar. Los estados de reacción intermedios fueron: HO 2 , H 2 O 2 , a continuación, H 3 O 2 y el producto final de reacción (dímeros de moléculas de agua), después de lo cual la molécula de agua se desorbe de la superficie del catalizador.
Reacción energética
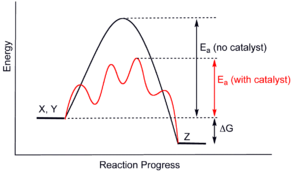
Los catalizadores funcionan proporcionando un mecanismo (alternativo) que implica un estado de transición diferente y una energía de activación inferior. En consecuencia, más colisiones moleculares tienen la energía necesaria para alcanzar el estado de transición. Por lo tanto, los catalizadores pueden permitir reacciones que de otro modo serían bloqueadas o ralentizadas por una barrera cinética. El catalizador puede aumentar la velocidad de reacción o la selectividad, o permitir la reacción a temperaturas más bajas. Este efecto se puede ilustrar con un diagrama de perfil de energía.
En la reacción catalizada primaria, catalizadores qué no cambiar la extensión de una reacción: no tienen ningún efecto sobre el equilibrio químico de una reacción porque la velocidad tanto de la reacción directa como de la inversa se ve afectada (ver también termodinámica). La segunda ley de la termodinámica describe por qué un catalizador no cambia el equilibrio químico de una reacción. Supongamos que existiera tal catalizador que cambiara el equilibrio. La introducción del catalizador en el sistema daría como resultado una reacción para pasar al nuevo equilibrio, produciendo energía. La producción de energía es un resultado necesario ya que las reacciones son espontáneas solo si se produce energía libre de Gibbs, y si no hay barrera de energía, no hay necesidad de un catalizador. Entonces, remover el catalizador también resultaría en reacción, produciendo energía; es decir, la adición y su proceso inverso, eliminación, ambos producirían energía. Así,
Si un catalizador que hace cambiar el equilibrio, entonces debe ser consumida como el producto de reacción, y por lo tanto también es un reactivo. Es ilustrativa la hidrólisis catalizada por base de ésteres, donde el ácido carboxílico producido reacciona inmediatamente con el catalizador base y, por lo tanto, el equilibrio de la reacción se desplaza hacia la hidrólisis.
La unidad derivada de SI para medir la actividad catalítica de un catalizador es el katal, que es moles por segundo. La productividad de un catalizador puede describirse por el número de vuelco(o TON) y la actividad catalítica por la frecuencia de giro (TOF), que es la TON por unidad de tiempo. El equivalente bioquímico es la unidad de enzima. Para obtener más información sobre la eficacia de la catálisis enzimática, consulte el artículo sobre enzimas .
El catalizador estabiliza el estado de transición más de lo que estabiliza el material de partida. Disminuye la barrera cinética al disminuir la diferencia de energía entre el material de partida y el estado de transición. Es no cambia la diferencia de energía entre los materiales de partida y productos (de barrera termodinámica), o la energía disponible (esto es proporcionado por el medio ambiente en forma de calor o de la luz).
Materiales
La naturaleza química de los catalizadores es tan diversa como la catálisis en sí misma, aunque se pueden hacer algunas generalizaciones. Los ácidos protónicos son probablemente los catalizadores más utilizados, especialmente para las numerosas reacciones que involucran agua, incluida la hidrólisis y su reverso. Los sólidos multifuncionales a menudo son catalíticamente activos, por ejemplo, zeolitas, alúmina, óxidos de orden superior, carbono grafítico, nanopartículas, nanodots y facetas de materiales a granel. Los metales de transición se usan a menudo para catalizar reacciones redox (oxidación, hidrogenación). Ejemplos son el níquel, como el níquel Raney para la hidrogenación, y el óxido de vanadio (V) para la oxidación del dióxido de azufre en trióxido de azufre mediante el denominado proceso de contacto. Muchos procesos catalíticos, especialmente aquellos utilizados en síntesis orgánica, requieren "metales de transición tardíos", como paladio, platino, oro, rutenio, rodio,
Algunos de los llamados catalizadores son realmente precatalizadores . Los precatalizadores se convierten en catalizadores en la reacción. Por ejemplo, el catalizador de Wilkinson RhCl (PPh 3 ) 3 pierde un ligando trifenilfosfina antes de entrar en el verdadero ciclo catalítico. Los precatalizadores son más fáciles de almacenar pero se activan fácilmente in situ. Debido a este paso de preactivación, muchas reacciones catalíticas implican un período de inducción.
Las especies químicas que mejoran la actividad catalítica se llaman co-catalizadores ( cocatalizadores ) o promotores en catálisis cooperativa .
Tipos
Los catalizadores pueden ser heterogéneos u homogéneos, dependiendo de si existe un catalizador en la misma fase que el sustrato. Los biocatalizadores (enzimas) se ven a menudo como un grupo separado.
Catalizadores heterogéneos
Los catalizadores heterogéneos actúan en una fase diferente a los reactivos. La mayoría de los catalizadores heterogéneos son sólidos que actúan sobre sustratos en una mezcla de reacción líquida o gaseosa. Se conocen diversos mecanismos para las reacciones en las superficies, según cómo se realice la adsorción (Langmuir-Hinshelwood, Eley-Rideal y Mars-van Krevelen). La superficie total del sólido tiene un efecto importante en la velocidad de reacción. Cuanto menor es el tamaño de partícula del catalizador, mayor es el área superficial para una masa dada de partículas.
Un catalizador heterogéneo tiene sitios activos , que son los átomos o las caras de cristal donde realmente ocurre la reacción. Dependiendo del mecanismo, el sitio activo puede ser una superficie de metal plana expuesta, un borde de cristal con valencia metálica imperfecta o una combinación complicada de los dos. Por lo tanto, no solo la mayor parte del volumen, sino también la mayor parte de la superficie de un catalizador heterogéneo puede ser catalíticamente inactiva. Descubrir la naturaleza del sitio activo requiere una investigación técnicamente desafiante. Por lo tanto, la investigación empírica para descubrir nuevas combinaciones de metales para la catálisis continúa.
Por ejemplo, en el proceso de Haber, el hierro finamente dividido sirve como catalizador para la síntesis de amoníaco a partir de nitrógeno e hidrógeno. Los gases reaccionantes se adsorben en sitios activos en las partículas de hierro. Una vez adsorbidos físicamente, los reactivos experimentan una quimisorción que produce la disociación en especies atómicas adsorbidas, y nuevos enlaces entre los fragmentos resultantes se forman en parte debido a su proximidad. De esta forma, se rompe el enlace triple particularmente fuerte en nitrógeno, que sería extremadamente poco común en la fase gaseosa debido a su alta energía de activación. Por lo tanto, la energía de activación de la reacción global se reduce y la velocidad de reacción aumenta. Otro lugar donde se aplica un catalizador heterogéneo es en la oxidación del dióxido de azufre en el óxido de vanadio (V) para la producción de ácido sulfúrico.
Los catalizadores heterogéneos son típicamente "soportados", lo que significa que el catalizador se dispersa en un segundo material que mejora la efectividad o minimiza su costo. Los soportes previenen o reducen la aglomeración y la sinterización de las pequeñas partículas de catalizador, exponiendo más área superficial, por lo tanto, los catalizadores tienen una actividad específica más alta (por gramo) en un soporte. A veces, el soporte es simplemente una superficie sobre la que se extiende el catalizador para aumentar el área de la superficie. Más a menudo, el soporte y el catalizador interactúan, afectando la reacción catalítica. Los soportes son materiales porosos con una gran área de superficie, más comúnmente alúmina, zeolitas o varios tipos de carbón activado. Los soportes especializados incluyen dióxido de silicio, dióxido de titanio, carbonato de calcio y sulfato de bario.
Electrocatalizadores
En el contexto de la electroquímica, específicamente en la ingeniería de pilas de combustible, se usan diversos catalizadores que contienen metales para mejorar las velocidades de las medias reacciones que comprenden la pila de combustible. Un tipo común de electrocatalizador de pila de combustible se basa en nanopartículas de platino que son compatibles con partículas de carbono ligeramente más grandes. Cuando está en contacto con uno de los electrodos en una pila de combustible, este platino aumenta la velocidad de reducción de oxígeno en el agua, en el hidróxido o en el peróxido de hidrógeno.
Catalizadores homogéneos
Los catalizadores homogéneos funcionan en la misma fase que los reactivos, pero los principios mecánicos implicados en la catálisis heterogénea son generalmente aplicables. Típicamente, los catalizadores homogéneos se disuelven en un disolvente con los sustratos. Un ejemplo de catálisis homogénea implica la influencia de H en la esterificación de ácidos carboxílicos, tales como la formación de acetato de metilo a partir de ácido acético y metanol. Un proceso de alto volumen que requiere un catalizador homogéneo es la hidroformilación, que agrega monóxido de carbono a un alqueno para producir un alquil aldehído. El aldehído se puede convertir en diversos productos tales como alcoholes o ácidos (por ejemplo, detergentes) o polioles (para plásticos tales como policarbonato o poliuretano). Para los químicos inorgánicos, la catálisis homogénea es a menudo sinónimo de catalizadores organometálicos.
Organocatálisis
Mientras que los metales de transición a veces atraen la mayor parte de la atención en el estudio de la catálisis, las pequeñas moléculas orgánicas sin metales también pueden exhibir propiedades catalíticas, como es evidente por el hecho de que muchas enzimas carecen de metales de transición. Típicamente, los catalizadores orgánicos requieren una mayor carga (cantidad de catalizador por unidad de cantidad de reactivo, expresada en% en moles de sustancia) que los catalizadores basados en metal de transición (-ion), pero estos catalizadores suelen estar comercialmente disponibles a granel, lo que ayuda a reducir costos. A principios de la década de 2000, estos organocatalizadores se consideraban de "nueva generación" y son competitivos frente a los catalizadores que contienen metales (-ión) tradicionales. Se supone que los organocatalizadores funcionan de manera similar a las enzimas exentas de metales que utilizan, por ejemplo, interacciones no covalentes tales como enlaces de hidrógeno.
Fotocatalizadores
La fotocatálisis es el fenómeno en el que el catalizador puede recibir luz (como la luz visible), promoverse a un estado excitado y luego someterse a un cruce entre sistemas con el material de partida, volviendo al estado fundamental sin ser consumido. El estado excitado del material de partida experimentará reacciones que ordinariamente no podría tener si se ilumina directamente. Por ejemplo, el oxígeno singlete generalmente se produce mediante fotocatálisis. Los fotocatalizadores también son el ingrediente principal en las células solares sensibilizadas por colorante.
Enzimas y biocatalizadores
En biología, las enzimas son catalizadores basados en proteínas en el metabolismo y el catabolismo. La mayoría de los biocatalizadores son enzimas, pero otras clases de biomoléculas no basadas en proteínas también exhiben propiedades catalíticas que incluyen ribozimas y desoxirribozimas sintéticas.
Los biocatalizadores pueden considerarse intermedios entre catalizadores homogéneos y heterogéneos, aunque estrictamente hablando, las enzimas solubles son catalizadores homogéneos y las enzimas unidas a la membrana son heterogéneas. Varios factores afectan la actividad de enzimas (y otros catalizadores) incluyendo temperatura, pH, concentración de enzima, sustrato y productos. Un reactivo particularmente importante en las reacciones enzimáticas es el agua, que es el producto de muchas reacciones formadoras de enlaces y un reactivo en muchos procesos de ruptura de enlaces.
En la biocatálisis, las enzimas se emplean para preparar muchos productos químicos básicos, incluidos el jarabe de maíz con alto contenido de fructosa y la acrilamida.
Algunos anticuerpos monoclonales cuyo objetivo de unión es una molécula estable que se asemeja al estado de transición de una reacción química pueden funcionar como catalizadores débiles para esa reacción química al disminuir su energía de activación. Tales anticuerpos catalíticos a veces se llaman "abzimas".
Nanocatalizadores
Los nanocatalizadores son nanomateriales con actividades catalíticas. Han sido ampliamente explorados para una amplia gama de aplicaciones. Entre ellos, los nanocatalizadores con actividades de imitación de enzimas se denominan colectivamente nanozimas.
Catálisis en tándem
En la catálisis en tándem, se acoplan dos o más catalizadores diferentes en una reacción de un solo recipiente.
Autocatálisis
En la autocatálisis, el catalizador es un producto de la reacción global, en contraste con todos los otros tipos de catálisis considerados en este artículo. El ejemplo más simple de autocatálisis es una reacción de tipo A + B → 2 B, en uno o en varios pasos. La reacción general es solo A → B, por lo que B es un producto. Pero dado que B también es un reactivo, puede estar presente en la ecuación de velocidad y afectar la velocidad de reacción. A medida que avanza la reacción, la concentración de B aumenta y puede acelerar la reacción como catalizador. En efecto, la reacción se acelera o se autocataliza.
Un ejemplo real es la hidrólisis de un éster tal como aspirina a un ácido carboxílico y un alcohol. En ausencia de catalizadores ácidos añadidos, el producto de ácido carboxílico cataliza la hidrólisis.
Significado
Un tubo de Ti-Cr-Pt (~ 40 μm de largo) libera burbujas de oxígeno cuando se sumerge en peróxido de hidrógeno (a través de la descomposición catalítica), formando una microbomba.
Se estima que el 90% de todos los productos químicos producidos comercialmente involucran catalizadores en alguna etapa del proceso de su fabricación. En 2005, los procesos catalíticos generaron alrededor de $ 900 mil millones en productos en todo el mundo. La catálisis es tan penetrante que las subáreas no se clasifican fácilmente. Algunas áreas de concentración particular se estudian a continuación.
Procesamiento de energía
La refinación de petróleo hace un uso intensivo de la catálisis para la alquilación, el craqueo catalítico (rompiendo hidrocarburos de cadena larga en piezas más pequeñas), la formación de nafta y la reforma de vapor (conversión de hidrocarburos en gas de síntesis). Incluso el escape de la quema de combustibles fósiles se trata mediante catálisis: los convertidores catalíticos, compuestos típicamente de platino y rodio, descomponen algunos de los subproductos más dañinos de los gases de escape de los automóviles.
- 2 CO + 2 NO → 2 CO 2 + N 2
Con respecto a los combustibles sintéticos, un proceso antiguo pero importante sigue siendo la síntesis Fischer-Tropsch de hidrocarburos a partir del gas de síntesis, que a su vez se procesa mediante reacciones de desplazamiento agua-gas, catalizadas por hierro. El biodiésel y los biocombustibles relacionados requieren un procesamiento a través de ambos inorgánicos y biocatalizadores.
Las pilas de combustible dependen de catalizadores para las reacciones anódica y catódica.
Los calentadores catalíticos generan calor sin llama a partir de un suministro de combustible combustible.
Productos químicos a granel
Algunos de los productos químicos a mayor escala se producen por oxidación catalítica, a menudo con oxígeno. Los ejemplos incluyen ácido nítrico (de amoníaco), ácido sulfúrico (de dióxido de azufre a trióxido de azufre por el proceso de contacto), ácido tereftálico de p-xileno y acrilonitrilo de propano y amoníaco.
Muchos otros productos químicos se generan por reducción a gran escala, a menudo a través de la hidrogenación. El ejemplo a mayor escala es el amoniaco, que se prepara a través del proceso de Haber a partir de nitrógeno. El metanol se prepara a partir de monóxido de carbono.
Los polímeros en masa derivados de etileno y propileno a menudo se preparan mediante catálisis de Ziegler-Natta. Los poliésteres, poliamidas e isocianatos se derivan mediante catálisis ácido-base.
La mayoría de los procesos de carbonilación requieren catalizadores metálicos, los ejemplos incluyen el proceso de ácido acético de Monsanto y la hidroformilación.
Productos químicos finos
Muchos productos químicos finos se preparan mediante catálisis; los métodos incluyen los de la industria pesada así como procesos más especializados que serían prohibitivamente caros a gran escala. Los ejemplos incluyen la reacción de Heck y las reacciones de Friedel-Crafts.
Debido a que la mayoría de los compuestos bioactivos son quirales, muchos productos farmacéuticos se producen mediante catálisis enantioselectiva (síntesis asimétrica catalítica).
Procesamiento de alimentos
Una de las aplicaciones más obvias de la catálisis es la hidrogenación (reacción con gas de hidrógeno) de las grasas que usan catalizador de níquel para producir margarina. Muchos otros alimentos se preparan mediante biocatálisis (ver a continuación).
Ambiente
La catálisis afecta el medio ambiente al aumentar la eficiencia de los procesos industriales, pero la catálisis también desempeña un papel directo en el medio ambiente. Un ejemplo notable es la función catalítica de los radicales libres de cloro en la descomposición del ozono. Estos radicales están formados por la acción de la radiación ultravioleta sobre los clorofluorocarbonos (CFC).
- Cl + O 3 → ClO + O 2
- ClO + O → Cl + O 2
Historia
En términos generales, cualquier cosa que aumente la velocidad de un proceso es un "catalizador", un término derivado del griego καταλύειν, que significa "anular", "desatar" o "levantar". El concepto de catálisis fue inventado por la química Elizabeth Fulhame y descrito en un libro de 1794, basado en su novedoso trabajo en experimentos de oxidación-reducción. El término catálisis fue utilizado más tarde por Jöns Jakob Berzelius en 1835 para describir reacciones que son aceleradas por sustancias que permanecen inalteradas después de la reacción. Fulhame, que precedió a Berzelius, trabajó con agua en lugar de con metales en sus experimentos de reducción. Otros químicos del siglo XVIII que trabajaron en catálisis fueron Eilhard Mitscherlich, que se refirió a ella como procesos de contacto , Desarrolló la lámpara de Döbereiner, un encendedor a base de hidrógeno y una esponja de platino, que se convirtió en un éxito comercial en la década de 1820 que perdura en la actualidad. Humphry Davy descubrió el uso del platino en la catálisis. En la década de 1880, Wilhelm Ostwald de la Universidad de Leipzig inició una investigación sistemática de las reacciones catalizadas por la presencia de ácidos y bases, y descubrió que las reacciones químicas se producen a tasas finitas y que estas tasas pueden usarse para determinar las concentraciones de ácidos y bases . Para este trabajo, Ostwald recibió el Premio Nobel de Química de 1909.
Inhibidores, venenos y promotores
Las sustancias que reducen la acción de los catalizadores se denominan inhibidores del catalizador si son reversibles, y los venenos del catalizador si son irreversibles. Los promotores son sustancias que aumentan la actividad catalítica, a pesar de que no son catalizadores por sí mismos.
Los inhibidores a veces se denominan "catalizadores negativos" ya que disminuyen la velocidad de reacción. Sin embargo, se prefiere el término inhibidor ya que no funcionan al introducir un camino de reacción con una energía de activación más alta; esto no reduciría la velocidad ya que la reacción continuaría ocurriendo por el camino no catalizado. Por el contrario, actúan desactivando los catalizadores o eliminando los intermedios de reacción, como los radicales libres.
El inhibidor puede modificar la selectividad además de la velocidad. Por ejemplo, en la reducción de alquinos a los alquenos, un catalizador (Pd) paladio en parte "envenenado" con el plomo (II) acetato de etilo (Pb (CH 3 CO 2 ) 2 ) se pueden utilizar. Sin la desactivación del catalizador, el alqueno producido se reduciría aún más a alcano.
El inhibidor puede producir este efecto, por ejemplo, envenenando selectivamente solo ciertos tipos de sitios activos. Otro mecanismo es la modificación de la geometría de la superficie. Por ejemplo, en operaciones de hidrogenación, grandes planos de la superficie metálica funcionan como sitios de catálisis por hidrogenólisis mientras que los sitios que catalizan la hidrogenación de compuestos insaturados son más pequeños. Por lo tanto, un veneno que cubra la superficie aleatoriamente tenderá a reducir la cantidad de planos grandes no contaminados pero dejará proporcionalmente más sitios más pequeños libres, cambiando así la hidrogenación frente a la selectividad de la hidrogenólisis. Muchos otros mecanismos también son posibles.
Los promotores pueden cubrir la superficie para evitar la producción de una estera de coque, o incluso eliminar activamente dicho material (p. Ej., Renio sobre platino en plataformas). Pueden ayudar a la dispersión del material catalítico o unirse a los reactivos.
Mercado actual
La demanda mundial de catalizadores en 2010 se estimó en aproximadamente 29.5 mil millones de dólares. Con la recuperación rápida de la industria automotriz y química en general, se espera que el mercado global de catalizadores experimente un rápido crecimiento en los próximos años.
Obtenido de: https://en.wikipedia.org/wiki/Catalysis