Electrón
Definición
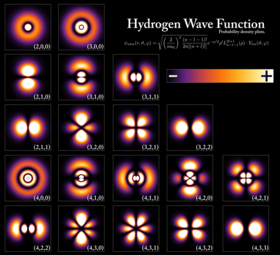
 Orbitales de átomos de hidrógeno a diferentes niveles de energía. Las áreas más opacas son donde es más probable encontrar un electrón en un momento dado. | |
Los electrones desempeñan un papel esencial en numerosos fenómenos físicos, como la electricidad, el magnetismo, la química y la conductividad térmica, y también participan en interacciones gravitacionales, electromagnéticas y débiles. Como un electrón tiene carga, tiene un campo eléctrico circundante, y si ese electrón se mueve en relación con un observador, generará un campo magnético. Los campos electromagnéticos producidos a partir de otras fuentes afectarán el movimiento de un electrón de acuerdo con la ley de fuerza de Lorentz. Los electrones irradian o absorben energía en forma de fotones cuando se aceleran. Los instrumentos de laboratorio son capaces de atrapar electrones individuales y plasma de electrones mediante el uso de campos electromagnéticos. Los telescopios especiales pueden detectar plasma de electrones en el espacio exterior. Los electrones están involucrados en muchas aplicaciones tales como electrónica, soldadura,
Las interacciones que involucran electrones con otras partículas subatómicas son de interés en campos como la química y la física nuclear. La interacción de fuerza de Coulomb entre los protones positivos dentro de los núcleos atómicos y los electrones negativos sin, permite la composición de los dos conocidos como átomos. La ionización o las diferencias en las proporciones de electrones negativos versus núcleos positivos cambian la energía de unión de un sistema atómico. El intercambio o intercambio de electrones entre dos o más átomos es la causa principal de los enlaces químicos. En 1838, el filósofo natural británico Richard Laming primero formuló la hipótesis del concepto de una cantidad indivisible de carga eléctrica para explicar las propiedades químicas de los átomos. El físico irlandés George Johnstone Stoney llamó a esta carga 'electrón' en 1891, y JJ Thomson y su equipo de físicos británicos lo identificaron como una partícula en 1897. Los electrones también pueden participar en reacciones nucleares, como la nucleosíntesis en estrellas, donde se las conoce como partículas beta. Los electrones se pueden crear a través de la desintegración beta de isótopos radiactivos y en colisiones de alta energía, por ejemplo cuando los rayos cósmicos ingresan a la atmósfera. La antipartícula del electrón se llama positrón; es idéntico al electrón, excepto que lleva cargas eléctricas y otras cargas del signo opuesto. Cuando un electrón colisiona con un positrón, ambas partículas pueden ser aniquiladas, produciendo fotones de rayos gamma. Los electrones se pueden crear a través de la desintegración beta de isótopos radiactivos y en colisiones de alta energía, por ejemplo cuando los rayos cósmicos ingresan a la atmósfera. La antipartícula del electrón se llama positrón; es idéntico al electrón, excepto que lleva cargas eléctricas y otras cargas del signo opuesto. Cuando un electrón colisiona con un positrón, ambas partículas pueden ser aniquiladas, produciendo fotones de rayos gamma. Los electrones se pueden crear a través de la desintegración beta de isótopos radiactivos y en colisiones de alta energía, por ejemplo cuando los rayos cósmicos ingresan a la atmósfera. La antipartícula del electrón se llama positrón; es idéntico al electrón, excepto que lleva cargas eléctricas y otras cargas del signo opuesto. Cuando un electrón colisiona con un positrón, ambas partículas pueden ser aniquiladas, produciendo fotones de rayos gamma.
Historia
Descubrimiento del efecto de la fuerza eléctrica
Los antiguos griegos notaron que el ámbar atraía objetos pequeños cuando se frotaba con pelo. Junto con los rayos, este fenómeno es una de las primeras experiencias registradas de la humanidad con la electricidad. En su tratado de 1600 De Magnete , el científico inglés William Gilbert acuñó el nuevo término latino electricus , para referirse a esta propiedad de atraer objetos pequeños después de ser frotado. Tanto la electricidad como la electricidad se derivan del latín ēlectrum (también la raíz de la aleación del mismo nombre), que proviene de la palabra griega para ámbar, ἤλεκτρον ( ēlektron ).
Descubrimiento de dos tipos de cargas
A principios de la década de 1700, Francis Hauksbee y el químico francés Charles François du Fay descubrieron independientemente lo que creían que eran dos clases de electricidad por fricción: una generada por el frotamiento de vidrio y la otra por la fricción de la resina. A partir de esto, du Fay teorizó que la electricidad consiste en dos fluidos eléctricos, vítreos y resinosos, que están separados por fricción, y que se neutralizan mutuamente cuando se combinan. El científico estadounidense Ebenezer Kinnersley también llegó a la misma conclusión de forma independiente. Una década después, Benjamin Franklin propuso que la electricidad no provenía de diferentes tipos de fluido eléctrico, sino de un solo fluido eléctrico que mostraba un exceso (+) o un déficit (-). Les dio la nomenclatura de carga moderna de positivo y negativo, respectivamente. Franklin pensó que el portador de carga era positivo, pero no identificó correctamente qué situación era un excedente del transportista de carga, y qué situación era un déficit.
Entre 1838 y 1851, el filósofo natural británico Richard Laming desarrolló la idea de que un átomo se compone de un núcleo de materia rodeado de partículas subatómicas que tenían cargas eléctricas unitarias. A partir de 1846, el físico alemán William Weber teorizó que la electricidad estaba compuesta de fluidos con carga positiva y negativa, y su interacción se regía por la ley del cuadrado inverso. Después de estudiar el fenómeno de la electrólisis en 1874, el físico irlandés George Johnstone Stoney sugirió que existía una "única cantidad definida de electricidad", la carga de un ion monovalente. Él fue capaz de estimar el valor de esta carga elemental e por medio de las leyes de electrólisis de Faraday. Sin embargo, Stoney creía que estas cargas estaban permanentemente unidas a los átomos y no podían ser eliminadas. En 1881, el físico alemán Hermann von Helmholtz argumentó que las cargas positiva y negativa se dividieron en partes elementales, cada una de las cuales "se comporta como átomos de electricidad".
Stoney inicialmente acuñó el término electrolion en 1881. Diez años más tarde, cambió a un electrón para describir estas cargas elementales, escribiendo en 1894: "... se hizo una estimación de la cantidad real de esta unidad fundamental de electricidad más notable, para la cual Desde entonces me he aventurado a sugerir el nombre de electrón ". Una propuesta de 1906 para cambiar a la electricidad falló porque Hendrik Lorentz prefirió mantener el electrón . La palabra electrón es una combinación de las palabras electr ic y i on . El sufijo - en que ahora se usa para designar otras partículas subatómicas, como un protón o un neutrón, a su vez deriva de un electrón.
Descubrimiento de electrones libres fuera de la materia
El físico alemán Johann Wilhelm Hittorf estudió la conductividad eléctrica en gases enrarecidos: en 1869, descubrió un brillo emitido por el cátodo que aumentaba de tamaño con la disminución de la presión del gas. En 1876, el físico alemán Eugen Goldstein demostró que los rayos de este resplandor arrojaban una sombra, y apodó los rayos rayos catódicos. Durante la década de 1870, el químico y físico inglés Sir William Crookes desarrolló el primer tubo de rayos catódicos para tener un alto vacío dentro. Luego mostró que los rayos de luminiscencia que aparecían dentro del tubo transportaban energía y se movían desde el cátodo al ánodo. Además, al aplicar un campo magnético, pudo desviar los rayos, demostrando así que el haz se comportó como si estuviera cargado negativamente. En 1879, propuso que estas propiedades podrían explicarse por lo que él llamó ' materia radiante '. Sugirió que este era un cuarto estado de la materia, que consistía en moléculas cargadas negativamente que se proyectaban a gran velocidad desde el cátodo.
El físico británico nacido en Alemania Arthur Schuster amplió los experimentos de Crookes colocando placas de metal paralelas a los rayos catódicos y aplicando un potencial eléctrico entre las placas. El campo desvió los rayos hacia la placa cargada positivamente, proporcionando evidencia adicional de que los rayos llevaban carga negativa. Midiendo la cantidad de deflexión para un nivel dado de corriente, en 1890 Schuster pudo estimar la relación carga-masa de los componentes del rayo. Sin embargo, esto produjo un valor que fue más de mil veces mayor de lo que se esperaba, por lo que se dio poca credibilidad a sus cálculos en ese momento.
En 1892, Hendrik Lorentz sugirió que la masa de estas partículas (electrones) podría ser una consecuencia de su carga eléctrica.
En 1896, el físico británico JJ Thomson, con sus colegas John S. Townsend y HA Wilson, realizó experimentos que indicaban que los rayos catódicos realmente eran partículas únicas, en lugar de ondas, átomos o moléculas, como se creía anteriormente. Thomson hizo buenas estimaciones tanto de la carga e como de la masa m , descubriendo que las partículas de los rayos catódicos, a las que llamó "corpúsculos", tenían quizás una milésima parte de la masa del ion menos masivo conocido: el hidrógeno. Mostró que su relación de carga a masa, e / m, era independiente del material del cátodo. Además, demostró que las partículas cargadas negativamente producidas por materiales radiactivos, por materiales calentados y por materiales iluminados eran universales. El físico irlandés George Johnstone Stoney volvió a proponer el nombre de electrón para estas partículas, y desde entonces el nombre ha ganado aceptación universal.
Mientras estudiaba minerales con fluorescencia natural en 1896, el físico francés Henri Becquerel descubrió que emitían radiación sin ninguna exposición a una fuente de energía externa. Estos materiales radiactivos se convirtieron en el tema de mucho interés de los científicos, incluido el físico neocelandés Ernest Rutherford, quien descubrió que emitían partículas. Él designó estas partículas alfa y beta, sobre la base de su capacidad para penetrar en la materia. En 1900, Becquerel demostró que los rayos beta emitidos por el radio podían ser desviados por un campo eléctrico, y que su relación masa-carga era la misma que para los rayos catódicos. Esta evidencia fortaleció la opinión de que los electrones existían como componentes de los átomos.
La carga del electrón fue más cuidadosamente medida por los físicos estadounidenses Robert Millikan y Harvey Fletcher en su experimento de caída de aceite de 1909, cuyos resultados se publicaron en 1911. Este experimento usó un campo eléctrico para evitar que una gota cargada de aceite cayera. un resultado de la gravedad. Este dispositivo podría medir la carga eléctrica de tan solo 1-150 iones con un margen de error de menos de 0.3%. Experimentos comparables habían sido realizados anteriormente por el equipo de Thomson, utilizando nubes de gotas de agua cargadas generadas por electrólisis, y en 1911 por Abram Ioffe, quien obtuvo independientemente el mismo resultado que Millikan utilizando micropartículas cargadas de metales, y luego publicó sus resultados en 1913. Sin embargo, las gotas de aceite fueron más estables que las gotas de agua debido a su velocidad de evaporación más lenta,
Alrededor del comienzo del siglo XX, se descubrió que bajo ciertas condiciones una partícula cargada de movimiento rápido causaba una condensación de vapor de agua sobresaturada a lo largo de su camino. En 1911, Charles Wilson usó este principio para diseñar su cámara de nubes para poder fotografiar las huellas de partículas cargadas, como los electrones de movimiento rápido.
Teoría atómica
Para 1914, los experimentos de los físicos Ernest Rutherford, Henry Moseley, James Franck y Gustav Hertz habían establecido en gran parte la estructura de un átomo como un núcleo denso de carga positiva rodeado de electrones de masa inferior. En 1913, el físico danés Niels Bohr postuló que los electrones residían en estados de energía cuantificados, con sus energías determinadas por el momento angular de la órbita del electrón sobre el núcleo. Los electrones podrían moverse entre esos estados, u órbitas, por la emisión o absorción de fotones de frecuencias específicas. Por medio de estas órbitas cuantificadas, explicó con precisión las líneas espectrales del átomo de hidrógeno. Sin embargo, el modelo de Bohr no pudo explicar las intensidades relativas de las líneas espectrales y no tuvo éxito en explicar los espectros de los átomos más complejos.
Los enlaces químicos entre los átomos fueron explicados por Gilbert Newton Lewis, quien en 1916 propuso que un par covalente de dos átomos se mantuviera entre ellos. Más tarde, en 1927, Walter Heitler y Fritz London dieron la explicación completa de la formación del par de electrones y la unión química en términos de mecánica cuántica. En 1919, el químico estadounidense Irving Langmuir elaboró sobre el modelo estático del átomo de Lewis y sugirió que todos los electrones se distribuían en sucesivas "capas concéntricas (casi) esféricas, todas de igual espesor". A su vez, dividió los caparazones en varias celdas, cada una de las cuales contenía un par de electrones. Con este modelo, Langmuir pudo explicar cualitativamente las propiedades químicas de todos los elementos en la tabla periódica,
En 1924, el físico austríaco Wolfgang Pauli observó que la estructura del átomo con forma de concha se podía explicar mediante un conjunto de cuatro parámetros que definían cada estado de energía cuántica, siempre que cada estado estuviera ocupado por no más de un solo electrón. Esta prohibición contra más de un electrón que ocupa el mismo estado de energía cuántica se conoce como el principio de exclusión de Pauli. El mecanismo físico para explicar el cuarto parámetro, que tenía dos valores posibles distintos, fue proporcionado por los físicos holandeses Samuel Goudsmit y George Uhlenbeck. En 1925, sugirieron que un electrón, además del momento angular de su órbita, posee un momento angular intrínseco y un momento dipolar magnético. Esto es análogo a la rotación de la Tierra sobre su eje mientras orbita el Sol. El momento angular intrínseco se conoce como giro, y explicó la división previamente misteriosa de las líneas espectrales observada con un espectrógrafo de alta resolución; este fenómeno se conoce como división de estructura fina.
Mecánica cuántica
En su disertación de 1924 Recherches sur la théorie des quanta (Investigación sobre la Teoría Cuántica), el físico francés Louis de Broglie hipotetizó que toda la materia se puede representar como una onda de Broglie a la manera de la luz. Es decir, bajo las condiciones apropiadas, los electrones y otras materias mostrarían propiedades de partículas u ondas. Las propiedades corpusculares de una partícula se demuestran cuando se muestra que tiene una posición localizada en el espacio a lo largo de su trayectoria en cualquier momento dado. La naturaleza ondulatoria de la luz se muestra, por ejemplo, cuando se pasa un rayo de luz a través de ranuras paralelas, creando así patrones de interferencia. En 1927, George Paget Thomson, descubrió que el efecto de interferencia se producía cuando un haz de electrones pasaba a través de delgadas hojas de metal y los físicos estadounidenses Clinton Davisson y Lester Germer por el reflejo de electrones de un cristal de níquel.
La predicción de De Broglie sobre la naturaleza ondulatoria de los electrones llevó a Erwin Schrödinger a postular una ecuación de onda para los electrones que se mueven bajo la influencia del núcleo en el átomo. En 1926, esta ecuación, la ecuación de Schrödinger, describió con éxito cómo se propagaban las ondas de electrones. En lugar de producir una solución que determinara la ubicación de un electrón a lo largo del tiempo, esta ecuación de onda también podría usarse para predecir la probabilidad de encontrar un electrón cerca de una posición, especialmente una posición cerca del lugar donde el electrón estaba en el espacio, para lo cual el electrón Las ecuaciones de onda no cambiaron con el tiempo. Este enfoque condujo a una segunda formulación de la mecánica cuántica (la primera de Heisenberg en 1925), y soluciones de la ecuación de Schrödinger, como la de Heisenberg, proporcionaba derivaciones de los estados de energía de un electrón en un átomo de hidrógeno que eran equivalentes a los que habían sido derivados primero por Bohr en 1913, y que se sabía que reproducían el espectro de hidrógeno. Una vez que el giro y la interacción entre múltiples electrones eran descriptibles, la mecánica cuántica hizo posible predecir la configuración de electrones en átomos con números atómicos mayores que el hidrógeno.
En 1928, basándose en el trabajo de Wolfgang Pauli, Paul Dirac produjo un modelo del electrón: la ecuación de Dirac, consistente con la teoría de la relatividad, aplicando consideraciones relativistas y de simetría a la formulación hamiltoniana de la mecánica cuántica del campo electromagnético. Para resolver algunos problemas dentro de su ecuación relativista, Dirac desarrolló en 1930 un modelo del vacío como un mar infinito de partículas con energía negativa, más tarde apodado el mar Dirac. Esto lo llevó a predecir la existencia de un positrón, la contrapartida antimateria del electrón. Esta partícula fue descubierta en 1932 por Carl Anderson, quien propuso llamar a los electrones estándar a los negativos y usar el electrón como un término genérico para describir las variantes con carga positiva y negativa.
En 1947, Willis Lamb, trabajando en colaboración con el estudiante graduado Robert Retherford, descubrió que ciertos estados cuánticos del átomo de hidrógeno, que deberían tener la misma energía, se desplazaron uno con respecto al otro, la diferencia se llamó el cambio Lamb. Casi al mismo tiempo, Polykarp Kusch, trabajando con Henry M. Foley, descubrió que el momento magnético del electrón es ligeramente más grande de lo que predice la teoría de Dirac. Esta pequeña diferencia fue luego llamada momento dipolar magnético anómalo del electrón. Esta diferencia fue explicada más tarde por la teoría de la electrodinámica cuántica, desarrollada por Sin-Itiro Tomonaga, Julian Schwinger y Richard Feynman a fines de la década de 1940.
Aceleradores de partículas
Con el desarrollo del acelerador de partículas durante la primera mitad del siglo XX, los físicos comenzaron a profundizar en las propiedades de las partículas subatómicas. El primer intento exitoso de acelerar electrones usando la inducción electromagnética fue hecho en 1942 por Donald Kerst. Su betatrón inicial alcanzó energías de 2.3 MeV, mientras que los betatrones posteriores alcanzaron 300 MeV. En 1947, la radiación de sincrotrón se descubrió con un sincrotrón de electrones de 70 MeV en General Electric. Esta radiación fue causada por la aceleración de electrones a través de un campo magnético cuando se movían cerca de la velocidad de la luz.
Con una energía de haz de 1.5 GeV, el primer colisionador de partículas de alta energía fue ADONE, que comenzó a funcionar en 1968. Este dispositivo aceleró electrones y positrones en direcciones opuestas, duplicando efectivamente la energía de su colisión en comparación con un blanco estático con un electrón. El Gran Colisionador de Electrones y Positrones (LEP) en el CERN, que estuvo operativo entre 1989 y 2000, logró energías de colisión de 209 GeV e hizo mediciones importantes para el Modelo Estándar de física de partículas.
Confinamiento de electrones individuales
Los electrones individuales ahora pueden confinarse fácilmente en transistores CMOS ultra pequeños ( L = 20 nm , W = 20 nm ) operados a temperatura criogénica en un rango de -269 ° C (4 K) a aproximadamente -258 ° C (15 K). La función de onda de electrones se propaga en una red de semiconductores e interacciona de forma insignificante con los electrones de la banda de valencia, por lo que puede tratarse en el formalismo de partículas individuales, reemplazando su masa con el tensor de masa efectivo.
Características
Clasificación
En el Modelo Estándar de física de partículas, los electrones pertenecen al grupo de partículas subatómicas llamadas leptones, que se cree que son partículas fundamentales o elementales. Los electrones tienen la masa más baja de cualquier leptón cargado (o partículas cargadas eléctricamente de cualquier tipo) y pertenecen a la primera generación de partículas fundamentales. La segunda y la tercera generación contienen leptones cargados, el muón y el tau, que son idénticos al electrón a cargo, el giro y las interacciones, pero son más masivos. Los leptones se diferencian del otro constituyente básico de la materia, los quarks, por su falta de interacción fuerte. Todos los miembros del grupo lepton son fermiones, porque todos tienen un entero de spin medio; el electrón tiene girar 12 .
Propiedades fundamentales
La masa invariante de un electrón es de aproximadamente
9.109
× 10 kilogramos, o 5.489 × 10 unidades de masa atómica. Sobre la base del principio de equivalencia de masa-energía de Einstein, esta masa corresponde a una energía en reposo de 0.511 MeV. La relación entre la masa de un protón y la de un electrón es de alrededor de 1836. Las mediciones astronómicas muestran que la relación de masa de protón a electrón ha mantenido el mismo valor, según lo predicho por el Modelo Estándar, durante al menos la mitad de la edad de el universo.
9.109
× 10 kilogramos, o 5.489 × 10 unidades de masa atómica. Sobre la base del principio de equivalencia de masa-energía de Einstein, esta masa corresponde a una energía en reposo de 0.511 MeV. La relación entre la masa de un protón y la de un electrón es de alrededor de 1836. Las mediciones astronómicas muestran que la relación de masa de protón a electrón ha mantenido el mismo valor, según lo predicho por el Modelo Estándar, durante al menos la mitad de la edad de el universo.
Los electrones tienen una carga eléctrica de -1.602 × 10 coulombs, que se usa como unidad de carga estándar para partículas subatómicas, y también se llama carga elemental. Esta carga elemental tiene una incertidumbre estándar relativa de 2.2 × 10 . Dentro de los límites de la precisión experimental, la carga del electrón es idéntica a la carga de un protón, pero con el signo opuesto. Como el símbolo e se usa para la carga elemental, el electrón se simboliza comúnmente por
e -
, donde el signo menos indica la carga negativa. El positrón está simbolizado por
e +
porque tiene las mismas propiedades que el electrón, pero con una carga positiva en lugar de negativa.
e -
, donde el signo menos indica la carga negativa. El positrón está simbolizado por
e +
porque tiene las mismas propiedades que el electrón, pero con una carga positiva en lugar de negativa.
El electrón tiene un momento angular intrínseco o espín de 12 . Esta propiedad generalmente se establece al referirse al electrón como una partícula de spin-
1
2 . Para tales partículas de la magnitud giro es √ 32 ħ . mientras que el resultado de la medición de una proyección del giro en cualquier eje solo puede ser ± ħ2 . Además del giro, el electrón tiene un momento magnético intrínseco a lo largo de su eje de giro. Es aproximadamente igual a un magnetón de Bohr, que es una constante física igual a 9.274 009 15 (23) × 10 joules por tesla. La orientación del giro con respecto al momento del electrón define la propiedad de las partículas elementales conocidas como helicidad.
1
2 . Para tales partículas de la magnitud giro es √ 32 ħ . mientras que el resultado de la medición de una proyección del giro en cualquier eje solo puede ser ± ħ2 . Además del giro, el electrón tiene un momento magnético intrínseco a lo largo de su eje de giro. Es aproximadamente igual a un magnetón de Bohr, que es una constante física igual a 9.274 009 15 (23) × 10 joules por tesla. La orientación del giro con respecto al momento del electrón define la propiedad de las partículas elementales conocidas como helicidad.
El electrón no tiene subestructura conocida y se supone que es una partícula puntual con una carga puntual y sin extensión espacial. En la física clásica, el momento angular y el momento magnético de un objeto dependen de sus dimensiones físicas. Por lo tanto, el concepto de un electrón adimensional que posee estas propiedades contrasta con las observaciones experimentales en las trampas de Penning que apuntan al radio finito no nulo del electrón. Una posible explicación de esta situación paradójica se presenta a continuación en la subsección "Partículas virtuales" tomando en consideración la transformación Foldy-Wouthuysen.
La cuestión del radio del electrón es un problema desafiante de la física teórica moderna. La admisión de la hipótesis de un radio finito del electrón es incompatible con las premisas de la teoría de la relatividad. Por otro lado, un electrón puntual (radio cero) genera serias dificultades matemáticas debido a la autoenergía del electrón que tiende al infinito.
La observación de un solo electrón en una trampa Penning sugiere que el límite superior del radio de la partícula es de 10 metros. El límite superior del radio de electrones de 10 metros se puede derivar usando la relación de incertidumbre en energía.
No es también una constante física llamada el "radio clásico del electrón", con el valor mucho mayor de 2,8179 × 10 m , mayor que el radio del protón. Sin embargo, la terminología proviene de un cálculo simplista que ignora los efectos de la mecánica cuántica; en realidad, el llamado radio clásico de electrones tiene poco que ver con la verdadera estructura fundamental del electrón.
Hay partículas elementales que decaen espontáneamente en partículas menos masivas. Un ejemplo es el muón, con una vida media de 2,2 × 10 segundos, que se descompone en un electrón, un neutrino de muón y un antineutrino de electrones. El electrón, por otro lado, se cree que es estable por razones teóricas: el electrón es la partícula menos masiva con carga eléctrica distinta de cero, por lo que su deterioro violaría la conservación de la carga. El límite inferior experimental para la duración media del electrón es de 6,6 × 10 años, con un nivel de confianza del 90%.
Propiedades cuánticas
Como con todas las partículas, los electrones pueden actuar como ondas. Esto se llama dualidad onda-partícula y se puede demostrar utilizando el experimento de doble rendija.
La naturaleza ondulatoria del electrón le permite pasar a través de dos rendijas paralelas simultáneamente, en lugar de una sola rendija, como sería el caso de una partícula clásica. En la mecánica cuántica, la propiedad ondulatoria de una partícula puede describirse matemáticamente como una función de valor complejo, la función de onda, comúnmente indicada por la letra griega psi ( ψ ). Cuando el valor absoluto de esta función se cuadra, da la probabilidad de que se observe una partícula cerca de una ubicación: una densidad de probabilidad.
Los electrones son partículas idénticas porque no se pueden distinguir entre sí por sus propiedades físicas intrínsecas. En la mecánica cuántica, esto significa que un par de electrones interactuantes deben poder intercambiar posiciones sin un cambio observable en el estado del sistema. La función de onda de los fermiones, incluidos los electrones, es antisimétrica, lo que significa que cambia de signo cuando se intercambian dos electrones; es decir, ψ ( r 1 , r 2 ) = - ψ ( r 2 , r 1 ) , donde las variables r 1 y r 2 corresponden al primer y segundo electrones, respectivamente. Dado que el valor absoluto no se modifica mediante un cambio de signo, esto corresponde a probabilidades iguales. Los bosones, como el fotón, tienen funciones de onda simétrica en su lugar.
En el caso de la antisimetría, las soluciones de la ecuación de onda para los electrones que interactúan dan como resultado una probabilidad cero de que cada par ocupe la misma ubicación o estado. Esto es responsable del principio de exclusión de Pauli, que impide que dos electrones ocupen el mismo estado cuántico. Este principio explica muchas de las propiedades de los electrones. Por ejemplo, causa que grupos de electrones enlazados ocupen diferentes orbitales en un átomo, en lugar de superponerse entre sí en la misma órbita.
Partículas virtuales
En una imagen simplificada, cada fotón pasa algún tiempo como una combinación de un electrón virtual más su antipartícula, el positrón virtual, que rápidamente se aniquila entre sí poco después. La combinación de la variación de la energía necesaria para crear estas partículas, y el tiempo durante el que existen, caiga por debajo del umbral de detectabilidad expresado por la relación de incertidumbre de Heisenberg, Δ E • Δ t ≥ ħ . En efecto, la energía necesaria para crear estas partículas virtuales, Δ E , se puede "tomar prestada" del vacío durante un período de tiempo, Δ t , de modo que su producto no sea más que la constante de Planck reducida, ħ ≈ 6,6 × 10 eV • s. Por lo tanto, para un electrón virtual, Δ t es como máximo de 1,3 × 10 s .
Mientras que existe un par virtual electrón-positrón, la fuerza coulomb del campo eléctrico ambiental que rodea un electrón provoca que un positrón creado sea atraído por el electrón original, mientras que un electrón creado experimenta una repulsión. Esto causa lo que se llama polarización de vacío. En efecto, el vacío se comporta como un medio que tiene una permitividad dieléctrica mayor que la unidad. Por lo tanto, la carga efectiva de un electrón es en realidad más pequeña que su valor real, y la carga disminuye al aumentar la distancia desde el electrón. Esta polarización se confirmó experimentalmente en 1997 utilizando el acelerador de partículas japonés TRISTAN. Las partículas virtuales causan un efecto de protección comparable para la masa del electrón.
La interacción con partículas virtuales también explica la pequeña (alrededor del 0.1%) desviación del momento magnético intrínseco del electrón desde el magnetón de Bohr (el momento magnético anómalo). El acuerdo extraordinariamente preciso de esta diferencia predicha con el valor determinado experimentalmente se considera como uno de los grandes logros de la electrodinámica cuántica.
La aparente paradoja (mencionada anteriormente en la subsección de propiedades) de un electrón de partículas puntuales que tiene un momento angular intrínseco y un momento magnético puede explicarse por la formación de fotones virtuales en el campo eléctrico generado por el electrón. Estos fotones causan que el electrón se mueva de una manera nerviosa (conocida como zitterbewegung), lo que da como resultado un movimiento circular neto con precesión. Este movimiento produce tanto el giro como el momento magnético del electrón. En átomos, esta creación de fotones virtuales explica el desplazamiento de Lamb observado en líneas espectrales.
Interacción
Un electrón genera un campo eléctrico que ejerce una fuerza atractiva sobre una partícula con una carga positiva, como el protón, y una fuerza de repulsión sobre una partícula con una carga negativa. La fuerza de esta fuerza en la aproximación no relativista está determinada por la ley del cuadrado inverso de Coulomb. Cuando un electrón está en movimiento, genera un campo magnético. La ley de Ampère-Maxwell relaciona el campo magnético con el movimiento de masa de los electrones (la corriente) con respecto a un observador. Esta propiedad de inducción suministra el campo magnético que impulsa un motor eléctrico. El campo electromagnético de una partícula cargada en movimiento arbitraria se expresa mediante los potenciales de Liénard-Wiechert, que son válidos incluso cuando la velocidad de la partícula es cercana a la de la luz (relativista).
Cuando un electrón se mueve a través de un campo magnético, está sujeto a la fuerza de Lorentz que actúa perpendicularmente al plano definido por el campo magnético y la velocidad del electrón. Esta fuerza centrípeta hace que el electrón siga una trayectoria helicoidal a través del campo en un radio llamado gyroradius. La aceleración de este movimiento curvo induce al electrón a irradiar energía en forma de radiación sincrotrón. La emisión de energía a su vez causa un retroceso del electrón, conocido como la Fuerza Abraham-Lorentz-Dirac, que crea una fricción que ralentiza el electrón. Esta fuerza es causada por una retro-reacción del propio campo del electrón sobre sí mismo.
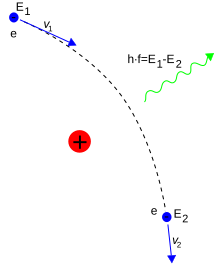
Los fotones median las interacciones electromagnéticas entre partículas en la electrodinámica cuántica. Un electrón aislado a una velocidad constante no puede emitir ni absorber un fotón real; hacerlo violaría la conservación de la energía y el impulso. En cambio, los fotones virtuales pueden transferir impulso entre dos partículas cargadas. Este intercambio de fotones virtuales, por ejemplo, genera la fuerza de Coulomb. La emisión de energía puede ocurrir cuando un electrón en movimiento es desviado por una partícula cargada, como un protón. La aceleración del electrón resulta en la emisión de radiación Bremsstrahlung.
Una colisión inelástica entre un fotón (luz) y un electrón solitario (libre) se denomina dispersión de Compton. Esta colisión resulta en una transferencia de momento y energía entre las partículas, que modifica la longitud de onda del fotón en una cantidad llamada desplazamiento de Compton. La magnitud máxima de este cambio de longitud de onda es h / m e c , que se conoce como la longitud de onda de Compton. Para un electrón, tiene un valor de 2.43 × 10 m . Cuando la longitud de onda de la luz es larga (por ejemplo, la longitud de onda de la luz visible es 0.4-0.7 μm) el desplazamiento de la longitud de onda es insignificante. Tal interacción entre la luz y los electrones libres se denomina dispersión de Thomson o dispersión lineal de Thomson.
La fuerza relativa de la interacción electromagnética entre dos partículas cargadas, como un electrón y un protón, viene dada por la constante de estructura fina. Este valor es una cantidad adimensional formada por la relación de dos energías: la energía electrostática de atracción (o repulsión) en una separación de una longitud de onda Compton, y la energía de reposo de la carga. Se da por alpha ≈ 7.297 353 × 10 , que es aproximadamente igual a 1137 .
Cuando los electrones y los positrones colisionan, se aniquilan entre sí, dando lugar a dos o más fotones de rayos gamma. Si el electrón y el positrón tienen un momento insignificante, se puede formar un átomo de positronio antes de que la aniquilación produzca dos o tres fotones de rayos gamma que totalicen 1.022 MeV. Por otro lado, un fotón de alta energía puede transformarse en un electrón y un positrón mediante un proceso llamado producción de pares, pero solo en presencia de una partícula cargada cercana, como un núcleo.
En la teoría de la interacción electrodébil, el componente zurdo de la función de onda del electrón forma un doblete de isospín débil con el neutrino de electrones. Esto significa que durante las interacciones débiles, los neutrinos electrónicos se comportan como electrones. Cualquiera de los miembros de este doblete puede experimentar una interacción de corriente cargada al emitir o absorber un
W
W
Z 0
intercambio, y esto es responsable de la dispersión elástica neutrino-electrón.
Átomos y moléculas
Un electrón puede estar ligado al núcleo de un átomo por la atractiva fuerza de Coulomb. Un sistema de uno o más electrones unidos a un núcleo se llama átomo. Si el número de electrones es diferente de la carga eléctrica del núcleo, dicho átomo se llama ion. El comportamiento ondulatorio de un electrón ligado se describe mediante una función llamada orbital atómico. Cada orbital tiene su propio conjunto de números cuánticos, como la energía, el momento angular y la proyección del momento angular, y solo un conjunto discreto de estos orbitales existe alrededor del núcleo. De acuerdo con el principio de exclusión de Pauli, cada orbital puede estar ocupado por hasta dos electrones, que deben diferir en su número cuántico de espín.
Los electrones pueden transferirse entre diferentes orbitales mediante la emisión o absorción de fotones con una energía que coincide con la diferencia de potencial. Otros métodos de transferencia orbital incluyen colisiones con partículas, como electrones, y el efecto Auger. Para escapar del átomo, la energía del electrón debe aumentarse por encima de su energía de enlace con el átomo. Esto ocurre, por ejemplo, con el efecto fotoeléctrico, donde un fotón incidente que excede la energía de ionización del átomo es absorbido por el electrón.
El momento angular orbital de los electrones se cuantifica. Debido a que el electrón está cargado, produce un momento magnético orbital que es proporcional al momento angular. El momento magnético neto de un átomo es igual a la suma vectorial de los momentos magnéticos orbitales y espín de todos los electrones y el núcleo. El momento magnético del núcleo es insignificante en comparación con el de los electrones. Los momentos magnéticos de los electrones que ocupan el mismo orbital (los llamados electrones emparejados) se anulan mutuamente.
El enlace químico entre átomos ocurre como resultado de interacciones electromagnéticas, tal como lo describen las leyes de la mecánica cuántica. Los enlaces más fuertes se forman compartiendo o transfiriendo electrones entre átomos, lo que permite la formación de moléculas. Dentro de una molécula, los electrones se mueven bajo la influencia de varios núcleos y ocupan orbitales moleculares; tanto como pueden ocupar orbitales atómicos en átomos aislados. Un factor fundamental en estas estructuras moleculares es la existencia de pares de electrones. Estos son electrones con espines opuestos, lo que les permite ocupar el mismo orbital molecular sin violar el principio de exclusión de Pauli (muy parecido a los átomos). Los diferentes orbitales moleculares tienen una distribución espacial diferente de la densidad de electrones. Por ejemplo, en pares enlazados (es decir, en los pares que realmente unen a los átomos) se pueden encontrar electrones con la probabilidad máxima en un volumen relativamente pequeño entre los núcleos. Por el contrario, en los pares no unidos los electrones se distribuyen en un gran volumen alrededor de los núcleos.
Conductividad
Si un cuerpo tiene más o menos electrones de los necesarios para equilibrar la carga positiva de los núcleos, entonces ese objeto tiene una carga eléctrica neta. Cuando hay un exceso de electrones, se dice que el objeto está cargado negativamente. Cuando hay menos electrones que la cantidad de protones en el núcleo, se dice que el objeto tiene carga positiva. Cuando el número de electrones y el número de protones son iguales, sus cargas se cancelan entre sí y se dice que el objeto es eléctricamente neutro. Un cuerpo macroscópico puede desarrollar una carga eléctrica a través del roce, por el efecto triboeléctrico.
Los electrones independientes que se mueven en el vacío se denominan electrones libres . Los electrones en los metales también se comportan como si fueran libres. En realidad, las partículas que comúnmente se denominan electrones en metales y otros sólidos son cuasi electrones, cuasipartículas, que tienen la misma carga eléctrica, giro y momento magnético que los electrones reales, pero pueden tener una masa diferente. Cuando los electrones libres (tanto en el vacío como en los metales) se mueven, producen un flujo neto de carga llamado corriente eléctrica, que genera un campo magnético. Del mismo modo, una corriente puede ser creada por un campo magnético cambiante. Estas interacciones se describen matemáticamente mediante las ecuaciones de Maxwell.
A una temperatura dada, cada material tiene una conductividad eléctrica que determina el valor de la corriente eléctrica cuando se aplica un potencial eléctrico. Ejemplos de buenos conductores incluyen metales como el cobre y el oro, mientras que el vidrio y el teflón son malos conductores. En cualquier material dieléctrico, los electrones permanecen unidos a sus respectivos átomos y el material se comporta como un aislante. La mayoría de los semiconductores tienen un nivel variable de conductividad que se encuentra entre los extremos de la conducción y el aislamiento. Por otro lado, los metales tienen una estructura de banda electrónica que contiene bandas electrónicas parcialmente llenas. La presencia de tales bandas permite que los electrones en los metales se comporten como si fueran electrones libres o deslocalizados. Estos electrones no están asociados con átomos específicos, por lo que cuando se aplica un campo eléctrico,
Debido a las colisiones entre los electrones y los átomos, la velocidad de deriva de los electrones en un conductor es del orden de milímetros por segundo. Sin embargo, la velocidad a la cual un cambio de corriente en un punto del material causa cambios en las corrientes en otras partes del material, la velocidad de propagación, es típicamente alrededor del 75% de la velocidad de la luz. Esto ocurre porque las señales eléctricas se propagan como una onda , con la velocidad dependiente de la constante dieléctrica del material.
Los metales son relativamente buenos conductores de calor, principalmente porque los electrones deslocalizados son libres de transportar energía térmica entre los átomos. Sin embargo, a diferencia de la conductividad eléctrica, la conductividad térmica de un metal es casi independiente de la temperatura. Esto se expresa matemáticamente mediante la ley de Wiedemann-Franz, que establece que la relación de conductividad térmica a la conductividad eléctrica es proporcional a la temperatura. El desorden térmico en la red metálica aumenta la resistividad eléctrica del material, produciendo una dependencia de la temperatura para la corriente eléctrica.
Cuando se enfrían por debajo de un punto llamado temperatura crítica, los materiales pueden experimentar una transición de fase en la que pierden toda la resistividad a la corriente eléctrica, en un proceso conocido como superconductividad. En la teoría BCS, este comportamiento está modelado por pares de electrones que entran en un estado cuántico conocido como condensado de Bose-Einstein. Estos pares de Cooper tienen su movimiento acoplado a la materia cercana a través de vibraciones de celosía llamadas fonones, evitando así las colisiones con átomos que normalmente crean resistencia eléctrica. (Los pares de Cooper tienen un radio de aproximadamente 100 nm, por lo que pueden superponerse entre sí). Sin embargo, el mecanismo por el que operan los superconductores de temperatura superior sigue siendo incierto.
Los electrones dentro de los sólidos conductores, que son cuasipartículas en sí mismos, cuando están estrechamente confinados a temperaturas cercanas al cero absoluto, se comportan como si se hubieran dividido en otras tres cuasipartículas: espinones, orbitas y holones. El primero lleva spin y momento magnético, el siguiente lleva su ubicación orbital mientras que el último carga eléctrica.
Movimiento y energía
Según la teoría de la relatividad especial de Einstein, cuando la velocidad de un electrón se acerca a la velocidad de la luz, desde el punto de vista de un observador su masa relativista aumenta, haciéndolo más y más difícil acelerarla desde el marco de referencia del observador. La velocidad de un electrón puede acercarse, pero nunca alcanzar, la velocidad de la luz en el vacío, c . Sin embargo, cuando los electrones relativistas -es decir, los electrones que se mueven a una velocidad cercana a c- se inyectan en un medio dieléctrico como el agua, donde la velocidad local de la luz es significativamente menor que c , los electrones viajan más rápido que la luz en el medio . A medida que interactúan con el medio, generan una luz tenue llamada radiación Cherenkov.
Los efectos de la relatividad especial se basan en una cantidad conocida como factor de Lorentz, definida como donde v es la velocidad de la partícula. La energía cinética K e de un electrón que se mueve con la velocidad v es:
donde m e es la masa de electrones. Por ejemplo, el acelerador lineal de Stanford puede acelerar un electrón a aproximadamente 51 GeV. Como un electrón se comporta como una onda, a una velocidad dada tiene una longitud de onda característica de Broglie. Esto viene dado por λ e = h / p donde h es la constante de Planck y p es el momento. Para el electrón 51 GeV anterior, la longitud de onda es de aproximadamente 2,4 × 10 m , lo suficientemente pequeña como para explorar estructuras muy por debajo del tamaño de un núcleo atómico.
Formación
La teoría del Big Bang es la teoría científica más ampliamente aceptada para explicar las primeras etapas de la evolución del Universo. Durante el primer milisegundo del Big Bang, las temperaturas superaban los 10 mil millones de kelvins y los fotones tenían energías medias superiores a un millón de electronvoltios. Estos fotones eran lo suficientemente energéticos como para reaccionar entre ellos y formar pares de electrones y positrones. Del mismo modo, los pares positrón-electrón se aniquilaron entre sí y emitieron fotones energéticos:
- γ + γ ↔ e + + e -
Un equilibrio entre electrones, positrones y fotones se mantuvo durante esta fase de la evolución del Universo. Sin embargo, después de 15 segundos, la temperatura del universo cayó por debajo del umbral donde podría ocurrir la formación de electrones positrónicos. La mayoría de los electrones y positrones supervivientes se aniquilaron mutuamente, liberando radiación gamma que recalentó brevemente el universo.
Por razones que siguen siendo inciertas, durante el proceso de aniquilación hubo un exceso en el número de partículas sobre las antipartículas. Por lo tanto, sobrevivió alrededor de un electrón por cada mil millones de pares electrón-positrón. Este exceso coincidía con el exceso de protones sobre antiprotones, en una condición conocida como asimetría bariónica, lo que resulta en una carga neta de cero para el universo. Los protones y neutrones supervivientes comenzaron a participar en reacciones entre sí, en el proceso conocido como nucleosíntesis, formando isótopos de hidrógeno y helio, con trazas de litio. Este proceso alcanzó su punto máximo después de unos cinco minutos. Cualquier neutrón sobrante sufrió una desintegración beta negativa con una vida media de alrededor de mil segundos, liberando un protón y un electrón en el proceso,
- n → p + e - + ν e
Durante aproximadamente los próximos 300 000 - 400 000 años , el exceso de electrones permaneció demasiado enérgico para unirse con los núcleos atómicos. Lo que siguió fue un período conocido como recombinación, cuando se formaron átomos neutros y el universo en expansión se volvió transparente a la radiación.
Aproximadamente un millón de años después del Big Bang, la primera generación de estrellas comenzó a formarse. Dentro de una estrella, la nucleosíntesis estelar da como resultado la producción de positrones a partir de la fusión de núcleos atómicos. Estas partículas de antimateria se aniquilan inmediatamente con electrones, liberando rayos gamma. El resultado neto es una reducción constante en el número de electrones y un aumento correspondiente en el número de neutrones. Sin embargo, el proceso de evolución estelar puede dar como resultado la síntesis de isótopos radiactivos. Los isótopos seleccionados pueden experimentar posteriormente una desintegración beta negativa, que emite un electrón y un antineutrino del núcleo. Un ejemplo es el isótopo de cobalto-60 (Co), que se descompone para formar níquel-60 ( 60
Ni
)
Ni
)
Al final de su vida útil, una estrella con más de 20 masas solares puede sufrir un colapso gravitacional para formar un agujero negro. De acuerdo con la física clásica, estos objetos estelares masivos ejercen una atracción gravitacional que es lo suficientemente fuerte como para evitar que algo, incluso la radiación electromagnética, escape más allá del radio de Schwarzschild. Sin embargo, se cree que los efectos mecánicos cuánticos permiten potencialmente la emisión de radiación Hawking a esta distancia. Se cree que los electrones (y los positrones) se crean en el horizonte de sucesos de estos restos estelares.
Cuando se crea un par de partículas virtuales (como un electrón y un positrón) en las proximidades del horizonte de sucesos, el posicionamiento espacial aleatorio puede hacer que uno de ellos aparezca en el exterior; este proceso se llama tunelización cuántica. El potencial gravitatorio del agujero negro puede suministrar la energía que transforma esta partícula virtual en una partícula real, lo que permite que se irradie al espacio. A cambio, el otro miembro del par recibe energía negativa, lo que resulta en una pérdida neta de energía de masa por el agujero negro. La velocidad de la radiación de Hawking aumenta con la disminución de la masa, lo que finalmente hace que el agujero negro se evapore hasta que, finalmente, explota.
Los rayos cósmicos son partículas que viajan a través del espacio con altas energías. Se han registrado eventos energéticos de hasta 3,0 × 10 eV . Cuando estas partículas colisionan con nucleones en la atmósfera de la Tierra, se genera una lluvia de partículas, incluidos piones. Más de la mitad de la radiación cósmica observada desde la superficie de la Tierra consiste en muones. La partícula llamada muón es un leptón producido en la atmósfera superior por la descomposición de un pión.
- π - → μ - + ν μ
Un muón, a su vez, puede descomponerse para formar un electrón o positrón.
- μ - → e - + ν e + ν μ
Observación
La observación remota de electrones requiere la detección de su energía radiada. Por ejemplo, en ambientes de alta energía como la corona de una estrella, los electrones libres forman un plasma que irradia energía debido a la radiación Bremsstrahlung. El gas de electrones puede experimentar oscilación de plasma, que son ondas causadas por variaciones sincronizadas en la densidad de electrones, y estas producen emisiones de energía que pueden detectarse mediante el uso de radiotelescopios.
La frecuencia de un fotón es proporcional a su energía. Como una transición de electrones enlazados entre diferentes niveles de energía de un átomo, absorbe o emite fotones a frecuencias características. Por ejemplo, cuando los átomos son irradiados por una fuente con un amplio espectro, aparecen líneas de absorción distintas en el espectro de radiación transmitida. Cada elemento o molécula muestra un conjunto característico de líneas espectrales, como la serie espectral de hidrógeno. Las mediciones espectroscópicas de la resistencia y el ancho de estas líneas permiten determinar la composición y las propiedades físicas de una sustancia.
En condiciones de laboratorio, las interacciones de los electrones individuales se pueden observar por medio de detectores de partículas, que permiten la medición de propiedades específicas tales como energía, spin y carga. El desarrollo de la trampa Paul y la trampa Penning permiten que las partículas cargadas queden contenidas dentro de una pequeña región durante largas duraciones. Esto permite mediciones precisas de las propiedades de las partículas. Por ejemplo, en un caso, se utilizó una trampa Penning para contener un solo electrón durante un período de 10 meses. El momento magnético del electrón se midió con una precisión de once dígitos, que, en 1980, era una precisión mayor que para cualquier otra constante física.
Las primeras imágenes de video de la distribución de energía de un electrón fueron tomadas por un equipo de la Universidad de Lund en Suecia, en febrero de 2008. Los científicos usaron flashes extremadamente cortos, llamados pulsos de attosegundos, que permitieron observar el movimiento de un electrón por primera vez.
La distribución de los electrones en materiales sólidos se puede visualizar mediante espectroscopía de fotoemisión con resolución en ángulo (ARPES). Esta técnica emplea el efecto fotoeléctrico para medir el espacio recíproco, una representación matemática de estructuras periódicas que se utiliza para inferir la estructura original. ARPES se puede usar para determinar la dirección, la velocidad y la dispersión de electrones dentro del material.
Aplicaciones de plasma
Haces de partículas
Los haces de electrones se utilizan en la soldadura. Permiten densidades de energía de hasta 10 W • cm a través de un diámetro de enfoque estrecho de 0.1-1.3 mm y generalmente no requieren material de relleno. Esta técnica de soldadura debe realizarse en un vacío para evitar que los electrones interactúen con el gas antes de alcanzar su objetivo, y puede usarse para unir materiales conductores que de otro modo se considerarían inadecuados para la soldadura.
La litografía por haz de electrones (EBL) es un método de grabado de semiconductores a resoluciones inferiores a un micrómetro. Esta técnica está limitada por los altos costos, el bajo rendimiento, la necesidad de operar el rayo en el vacío y la tendencia de los electrones a dispersarse en sólidos. El último problema limita la resolución a aproximadamente 10 nm. Por esta razón, EBL se utiliza principalmente para la producción de un pequeño número de circuitos integrados especializados.
El procesamiento del haz de electrones se utiliza para irradiar materiales con el fin de cambiar sus propiedades físicas o esterilizar productos médicos y alimenticios. Los haces de electrones fluidizan o cuasi derretir los vidrios sin un aumento significativo de la temperatura en la irradiación intensiva: por ejemplo, la radiación intensiva de electrones causa una disminución de muchos órdenes de magnitud de la viscosidad y una disminución escalonada de su energía de activación.
Los aceleradores de partículas lineales generan haces de electrones para el tratamiento de tumores superficiales en la radioterapia. La terapia con electrones puede tratar tales lesiones cutáneas como carcinomas de células basales porque un haz de electrones solo penetra hasta una profundidad limitada antes de ser absorbido, típicamente hasta 5 cm para energías de electrones en el rango de 5-20 MeV. Se puede usar un haz de electrones para complementar el tratamiento de áreas que han sido irradiadas con rayos X.
Los aceleradores de partículas usan campos eléctricos para propulsar los electrones y sus antipartículas a altas energías. Estas partículas emiten radiación sincrotrón a medida que atraviesan los campos magnéticos. La dependencia de la intensidad de esta radiación al girar polariza el haz de electrones, un proceso conocido como efecto Sokolov-Ternov. Los haces de electrones polarizados pueden ser útiles para diversos experimentos. La radiación de sincrotrón también puede enfriar los haces de electrones para reducir la dispersión del momento de las partículas. Los haces de electrones y positrones chocan cuando las partículas se aceleran a las energías requeridas; los detectores de partículas observan las emisiones de energía resultantes, que la física de partículas estudia.
Imágenes
La difracción de electrones de baja energía (LEED) es un método para bombardear un material cristalino con un haz de electrones colimado y luego observar los patrones de difracción resultantes para determinar la estructura del material. La energía requerida de los electrones está típicamente en el rango 20-200 eV. La técnica de reflexión de difracción de electrones de alta energía (RHEED) utiliza el reflejo de un haz de electrones disparado en varios ángulos bajos para caracterizar la superficie de los materiales cristalinos. La energía del haz está típicamente en el rango de 8-20 keV y el ángulo de incidencia es de 1-4 °.
El microscopio electrónico dirige un haz enfocado de electrones a una muestra. Algunos electrones cambian sus propiedades, como la dirección del movimiento, el ángulo y la fase relativa y la energía cuando el haz interactúa con el material. Los microscopistas pueden registrar estos cambios en el haz de electrones para producir imágenes del material atómicamente resueltas. En luz azul, los microscopios ópticos convencionales tienen una resolución limitada por difracción de aproximadamente 200 nm. En comparación, los microscopios electrónicos están limitados por la longitud de onda de De Broglie del electrón. Esta longitud de onda, por ejemplo, es igual a 0.0037 nm para electrones acelerados a través de un potencial de 100.000 voltios. El microscopio de corrección de la aberración de electrones de transmisión es capaz de una resolución inferior a 0,05 nm, que es más que suficiente para resolver átomos individuales. Esta capacidad hace que el microscopio electrónico sea un instrumento de laboratorio útil para imágenes de alta resolución. Sin embargo, los microscopios electrónicos son instrumentos caros que son costosos de mantener.
Existen dos tipos principales de microscopios electrónicos: transmisión y exploración. Los microscopios de electrones de transmisión funcionan como retroproyectores, con un rayo de electrones que pasa a través de una porción de material que luego se proyecta mediante lentes en una diapositiva fotográfica o un dispositivo de carga acoplada. Los microscopios electrónicos de barrido trazan un haz de electrones finamente enfocado, como en un televisor, a través de la muestra estudiada para producir la imagen. Las ampliaciones varían desde 100 × hasta 1,000,000 × o más para ambos tipos de microscopios. El microscopio de efecto túnel utiliza un túnel cuántico de electrones desde una punta metálica afilada hacia el material estudiado y puede producir imágenes de su superficie con resolución atómica.
Otras aplicaciones
En el láser de electrones libres (FEL), un haz de electrones relativista pasa a través de un par de onduladores que contienen matrices de imanes dipolos cuyos campos apuntan en direcciones alternas. Los electrones emiten radiación de sincrotrón que interactúa coherentemente con los mismos electrones para amplificar fuertemente el campo de radiación a la frecuencia de resonancia. FEL puede emitir una radiación electromagnética coherente de alto brillo con una amplia gama de frecuencias, desde microondas hasta rayos X blandos. Estos dispositivos se utilizan en la fabricación, la comunicación y en aplicaciones médicas, como la cirugía de tejidos blandos.
Los electrones son importantes en los tubos de rayos catódicos, que se han utilizado ampliamente como dispositivos de visualización en instrumentos de laboratorio, monitores de computadoras y televisores. En un tubo fotomultiplicado, cada fotón que golpea el fotocátodo inicia una avalancha de electrones que produce un pulso de corriente detectable. Los tubos de vacío utilizan el flujo de electrones para manipular las señales eléctricas, y desempeñaron un papel fundamental en el desarrollo de la tecnología electrónica. Sin embargo, han sido suplantados en gran medida por dispositivos de estado sólido como el transistor.
Obtenido de: https://en.wikipedia.org/wiki/Electron