Química
Definición
La química es la disciplina científica involucrada con compuestos compuestos de átomos, es decir, elementos y moléculas, es decir, combinaciones de átomos: su composición, estructura, propiedades, comportamiento y los cambios que experimentan durante una reacción con otros compuestos. La química aborda temas como la interacción de átomos y moléculas a través de enlaces químicos para formar nuevos compuestos químicos. Existen cuatro tipos de enlaces químicos: enlaces covalentes, en los que los compuestos comparten uno o más electrones; enlaces iónicos, en los que un compuesto dona uno o más electrones a otro compuesto para producir iones (cationes y aniones); enlaces de hidrógeno; y bonos de fuerza de Van der Waals.En el ámbito de su tema, la química ocupa una posición intermedia entre la física y la biología. A veces se la denomina ciencia central porque proporciona una base para comprender las disciplinas científicas básicas y aplicadas en un nivel fundamental. Los ejemplos incluyen la química de plantas (botánica), la formación de rocas ígneas (geología), cómo se forma el ozono atmosférico y cómo se degradan los contaminantes ambientales (ecología), las propiedades del suelo en la luna (astrofísica), cómo funcionan los medicamentos (farmacología) y cómo recolectar evidencia de ADN en la escena del crimen (análisis forense).
La historia de la química abarca un período desde los tiempos más antiguos hasta el presente. Desde varios milenios antes de Cristo, las civilizaciones usaban tecnologías que eventualmente formarían la base de las diversas ramas de la química. Los ejemplos incluyen extraer metales de los minerales, hacer cerámica y esmaltes, fermentar cerveza y vino, extraer productos químicos de plantas para medicinas y perfumes, convertir la grasa en jabón, hacer vidrio y fabricar aleaciones como el bronce. La química fue precedida por su protoscience, Alchemy, que es un enfoque intuitivo pero no científico para comprender los componentes de la materia y sus interacciones. No tuvo éxito en explicar la naturaleza de la materia y sus transformaciones, pero al realizar experimentos y registrar los resultados, los alquimistas preparó el escenario para la química moderna. The Sceptical Chymist (1661). Si bien tanto la alquimia y la química se refieren a la materia y sus transformaciones, la diferencia crucial fue dada por el método científico que utilizan los químicos en su trabajo. Se considera que la química se han convertido en una ciencia establecida con la obra de Antoine Lavoisier, quien desarrolló una ley de conservación de la masa que exigía la medición cuidadosa y observaciones cuantitativas de los fenómenos químicos. La historia de la química se entrelaza con la historia de la termodinámica, especialmente a través del trabajo de Willard Gibbs.
Etimología
La palabra química proviene de la alquimia, que se refería a un conjunto anterior de prácticas que abarcaban elementos de la química, la metalurgia, la filosofía, la astrología, la astronomía, el misticismo y la medicina. A menudo se considera vinculado a la búsqueda de convertir el plomo u otro material de partida común en oro, aunque en la antigüedad el estudio abarcó muchas de las cuestiones de la química moderna que se define como el estudio de la composición de las aguas, movimiento, crecimiento, encarnación , desencarnándolo, extrayendo los espíritus de los cuerpos y uniendo los espíritus dentro de los cuerpos a principios del siglo IV, el alquimista griego-egipcio Zósimos. Un alquimista fue llamado "químico" en el habla popular, y más tarde se agregó el sufijo "-ry" para describir el arte del químico como "química".
La palabra moderna alquimia a su vez se deriva de la palabra árabe al-kīmīā (الكیمیاء). En origen, el término está tomado del griego χημία o χημεία. Esto puede tener orígenes egipcios ya que al-kīmīā se deriva del griego χημία, que a su vez deriva de la palabra Kemet, que es el antiguo nombre de Egipto en el idioma egipcio. Alternativamente, al-kīmīā puede derivar de χημεία, que significa " fundirse ".
Principios modernos
El modelo actual de estructura atómica es el modelo mecánico cuántico. La química tradicional comienza con el estudio de partículas elementales, átomos, moléculas, sustancias, metales, cristales y otros agregados de materia. Esta materia se puede estudiar en estados sólidos, líquidos o gaseosos, aisladamente o en combinación. Las interacciones, reacciones y transformaciones que se estudian en la química suelen ser el resultado de las interacciones entre átomos, lo que conduce a reordenamientos de los enlaces químicos que mantienen unidos a los átomos. Tales comportamientos se estudian en un laboratorio de química.
El laboratorio de química usa estereotípicamente varias formas de cristalería de laboratorio. Sin embargo, la cristalería no es fundamental para la química, y una gran cantidad de química experimental (así como aplicada / industrial) se realiza sin ella.
Una reacción química es una transformación de algunas sustancias en una o más sustancias diferentes. La base de tal transformación química es la reordenación de los electrones en los enlaces químicos entre los átomos. Se puede representar simbólicamente a través de una ecuación química, que generalmente involucra átomos como sujetos. El número de átomos a la izquierda y a la derecha en la ecuación para una transformación química es igual. (Cuando el número de átomos en cada lado es desigual, la transformación se conoce como reacción nuclear o decaimiento radioactivo.) El tipo de reacciones químicas que puede sufrir una sustancia y los cambios de energía que pueden acompañarla están limitadas por ciertas reglas básicas, conocido como leyes químicas.
Las consideraciones de energía y entropía son invariablemente importantes en casi todos los estudios químicos. Las sustancias químicas se clasifican en términos de su estructura, fase, así como sus composiciones químicas. Se pueden analizar utilizando las herramientas de análisis químico, por ejemplo, espectroscopía y cromatografía. Los científicos dedicados a la investigación química son conocidos como químicos. La mayoría de los químicos se especializan en una o más subdisciplinas. Varios conceptos son esenciales para el estudio de la química; algunos de ellos son:
Importar
En química, la materia se define como cualquier cosa que tenga masa y volumen en reposo (ocupa espacio) y está compuesta de partículas. Las partículas que componen la materia también tienen masa en reposo, no todas las partículas tienen masa en reposo, como el fotón. La materia puede ser una sustancia química pura o una mezcla de sustancias.
Átomo
El átomo es la unidad básica de la química. Consiste en un núcleo denso llamado núcleo atómico rodeado por un espacio ocupado por una nube de electrones. El núcleo está formado por protones con carga positiva y neutrones sin carga (denominados en conjunto nucleones), mientras que la nube de electrones está compuesta por electrones cargados negativamente que orbitan el núcleo. En un átomo neutral, los electrones cargados negativamente equilibran la carga positiva de los protones. El núcleo es denso; la masa de un nucleón es aproximadamente 1.836 veces mayor que la de un electrón, sin embargo, el radio de un átomo es aproximadamente 10.000 veces superior al de su núcleo.
El átomo es también la entidad más pequeña que se puede concebir para retener las propiedades químicas del elemento, como la electronegatividad, el potencial de ionización, los estados de oxidación preferidos, el número de coordinación y los tipos preferidos de enlaces para formar (p. Ej., Metálico, iónico , covalente).
Elemento
Un elemento químico es una sustancia pura que se compone de un solo tipo de átomo, caracterizado por su número particular de protones en los núcleos de sus átomos, conocidos como el número atómico y representadas por el símbolo Z . El número de masa es la suma de la cantidad de protones y neutrones en un núcleo. Aunque todos los núcleos de todos los átomos que pertenecen a un elemento tendrán el mismo número atómico, pueden no tener necesariamente el mismo número de masa; los átomos de un elemento que tienen diferentes números de masa se conocen como isótopos. Por ejemplo, todos los átomos con 6 protones en sus núcleos son átomos del elemento químico carbono, pero los átomos de carbono pueden tener números de masa de 12 o 13.
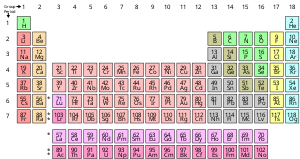
La presentación estándar de los elementos químicos se encuentra en la tabla periódica, que ordena los elementos por número atómico. La tabla periódica se organiza en grupos, o columnas, y períodos, o filas. La tabla periódica es útil para identificar tendencias periódicas.
Compuesto
Un compuesto es una sustancia química pura compuesta de más de un elemento. Las propiedades de un compuesto tienen poca similitud con las de sus elementos. La nomenclatura estándar de los compuestos es establecida por la Unión Internacional de Química Pura y Aplicada (IUPAC). Los compuestos orgánicos se nombran de acuerdo con el sistema de nomenclatura orgánica. Los nombres de compuestos inorgánicos se crean de acuerdo con el sistema de nomenclatura inorgánica. Cuando un compuesto tiene más de un componente, entonces se dividen en dos clases, los componentes electropositivo y electronegativo. Además, el Chemical Abstracts Service ha ideado un método para indexar sustancias químicas. En este esquema, cada sustancia química es identificable por un número conocido como su número de registro CAS.
Molécula
Una molécula es la porción indivisible más pequeña de una sustancia química pura que tiene su conjunto único de propiedades químicas, es decir, su potencial para experimentar un cierto conjunto de reacciones químicas con otras sustancias. Sin embargo, esta definición solo funciona bien para las sustancias que están compuestas por moléculas, lo que no ocurre con muchas sustancias (ver más abajo). Las moléculas son típicamente un conjunto de átomos unidos por enlaces covalentes, de modo que la estructura es eléctricamente neutra y todos los electrones de valencia se emparejan con otros electrones en enlaces o en pares solitarios.
Por lo tanto, las moléculas existen como unidades eléctricamente neutras, a diferencia de los iones. Cuando esta regla se rompe, dando una "carga" a la "molécula", el resultado a veces se denomina ion molecular o ion poliatómico. Sin embargo, la naturaleza discreta y separada del concepto molecular generalmente requiere que los iones moleculares estén presentes solo en forma bien separada, como un haz dirigido en un vacío en un espectrómetro de masas. Las colecciones poliatómicas cargadas que residen en sólidos (por ejemplo, iones de sulfato o nitrato comunes) generalmente no se consideran "moléculas" en la química. Algunas moléculas contienen uno o más electrones desapareados, creando radicales. La mayoría de los radicales son comparativamente reactivos, pero algunos, como el óxido nítrico (NO), pueden ser estables.
Los elementos de gas "inerte" o nobles (helio, neón, argón, criptón, xenón y radón) están compuestos de átomos solitarios como su unidad discreta más pequeña, pero los otros elementos químicos aislados consisten en moléculas o redes de átomos unidos entre sí. de alguna manera. Las moléculas identificables componen sustancias familiares como el agua, el aire y muchos compuestos orgánicos como el alcohol, el azúcar, la gasolina y varios productos farmacéuticos.
Sin embargo, no todas las sustancias o compuestos químicos consisten en moléculas discretas, y de hecho la mayoría de las sustancias sólidas que forman la corteza sólida, el manto y el núcleo de la Tierra son compuestos químicos sin moléculas. Estos otros tipos de sustancias, tales como compuestos iónicos y sólidos de red, están organizados de tal manera que carecen de la existencia de moléculas identificables per se . En cambio, estas sustancias se discuten en términos de unidades de fórmula o unidades de células como la estructura repetitiva más pequeña dentro de la sustancia. Ejemplos de tales sustancias son sales minerales (como la sal de mesa), sólidos como el carbono y el diamante, metales y minerales familiares de sílice y silicato como el cuarzo y el granito.
Una de las características principales de una molécula es su geometría a menudo llamada su estructura. Mientras que la estructura de las moléculas diatómicas, triatómicas o tetra atómicas puede ser trivial, (lineal, angular, piramidal, etc.) la estructura de las moléculas poliatómicas, que están constituidas por más de seis átomos (de varios elementos) puede ser crucial para su naturaleza química.
Sustancia y mezcla
  | |
  | |
  | |
| Ejemplos de sustancias químicas puras. De izquierda a derecha: los elementos estaño (Sn) y azufre (S), diamante (un alótropo de carbono), sacarosa (azúcar puro) y cloruro de sodio (sal) y bicarbonato de sodio (bicarbonato de sodio), que son compuestos iónicos . |
Una sustancia química es un tipo de materia con una composición definida y un conjunto de propiedades. Una colección de sustancias se llama mezcla. Ejemplos de mezclas son aire y aleaciones.
Topo y cantidad de sustancia
El mol es una unidad de medida que denota una cantidad de sustancia (también llamada cantidad química). La mole se define como la cantidad de átomos encontrados exactamente en 0.012 kilogramos (o 12 gramos) de carbono 12, donde los átomos de carbono 12 están libres, en reposo y en su estado fundamental. El número de entidades por mol se conoce como la constante de Avogadro, y se determina empíricamente que es aproximadamente 6.022 × 10 mol. La concentración molar es la cantidad de una sustancia particular por volumen de solución, y se informa comúnmente en mol / dm.
Fase
Además de las propiedades químicas específicas que distinguen las diferentes clasificaciones químicas, las sustancias químicas pueden existir en varias fases. En su mayor parte, las clasificaciones químicas son independientes de estas clasificaciones de fase masiva; sin embargo, algunas fases más exóticas son incompatibles con ciertas propiedades químicas. Una fase es un conjunto de estados de un sistema químico que tienen propiedades estructurales a granel similares, en un rango de condiciones, como presión o temperatura.
Las propiedades físicas, como la densidad y el índice de refracción, tienden a caer dentro de los valores característicos de la fase. La fase de la materia se define por la transición de fase , que es cuando la energía introducida o sacada del sistema entra en la reorganización de la estructura del sistema, en lugar de cambiar las condiciones de volumen.
A veces la distinción entre fases puede ser continua en lugar de tener un límite discreto, en este caso la materia se considera en estado supercrítico. Cuando tres estados se reúnen en función de las condiciones, se lo conoce como punto triple y como esto es invariante, es una forma conveniente de definir un conjunto de condiciones.
Los ejemplos más familiares de fases son sólidos, líquidos y gases. Muchas sustancias exhiben múltiples fases sólidas. Por ejemplo, hay tres fases de hierro sólido (alfa, gamma y delta) que varían en función de la temperatura y la presión. Una diferencia principal entre las fases sólidas es la estructura o disposición cristalina de los átomos. Otra fase comúnmente encontrada en el estudio de la química es la fase acuosa , que es el estado de las sustancias disueltas en solución acuosa (es decir, en agua).
Las fases menos familiares incluyen los plasmas, los condensados de Bose-Einstein y los condensados fermiónicos y las fases paramagnéticas y ferromagnéticas de los materiales magnéticos. Si bien la mayoría de las fases familiares se relacionan con sistemas tridimensionales, también es posible definir análogos en sistemas bidimensionales, que han recibido atención por su relevancia para los sistemas en biología.
Vinculación
Se dice que los átomos que se unen en moléculas o cristales están unidos entre sí. Un enlace químico se puede visualizar como el equilibrio multipole entre las cargas positivas en los núcleos y las cargas negativas que oscilan a su alrededor. Más que simple atracción y repulsión, las energías y distribuciones caracterizan la disponibilidad de un electrón para unirse a otro átomo.
Un enlace químico puede ser un enlace covalente, un enlace iónico, un enlace de hidrógeno o simplemente debido a la fuerza de Van der Waals. Cada uno de estos tipos de bonos se atribuye a algún potencial. Estos potenciales crean las interacciones que mantienen unidos a los átomos en moléculas o cristales. En muchos compuestos simples, la teoría del enlace de valencia, el modelo de repulsión de pares de electrones de Valence Shell (VSEPR) y el concepto de número de oxidación se pueden usar para explicar la estructura y composición molecular.
Un enlace iónico se forma cuando un metal pierde uno o más de sus electrones, convirtiéndose en un catión de carga positiva, y los electrones son adquiridos por el átomo no metálico, convirtiéndose en un anión de carga negativa. Los dos iones con carga opuesta se atraen entre sí, y el enlace iónico es la fuerza de atracción electrostática entre ellos. Por ejemplo, el sodio (Na), un metal, pierde un electrón para convertirse en un catión Na mientras que el cloro (Cl), un elemento no metálico, gana este electrón para convertirse en Cl. Los iones se mantienen unidos debido a la atracción electrostática y se forma ese compuesto de cloruro de sodio (NaCl) o sal de mesa común.
En un enlace covalente, uno o más pares de electrones de valencia son compartidos por dos átomos: el grupo eléctricamente neutro resultante de átomos enlazados se denomina molécula. Los átomos compartirán electrones de valencia de tal manera que creen una configuración de electrones de gas noble (ocho electrones en su capa más externa) para cada átomo. Se dice que los átomos que tienden a combinarse de tal manera que tienen ocho electrones en su capa de valencia siguen la regla del octeto. Sin embargo, algunos elementos como el hidrógeno y el litio necesitan solo dos electrones en su capa más externa para lograr esta configuración estable; se dice que estos átomos siguen la regla del dúo , y de esta forma están alcanzando la configuración electrónica del gas noble helio, que tiene dos electrones en su capa exterior.
Del mismo modo, las teorías de la física clásica se pueden utilizar para predecir muchas estructuras iónicas. Con compuestos más complicados, como los complejos metálicos, la teoría de los enlaces de valencia es menos aplicable y generalmente se utilizan enfoques alternativos, como la teoría del orbital molecular. Ver diagrama en orbitales electrónicos.
Energía
En el contexto de la química, la energía es un atributo de una sustancia como consecuencia de su estructura atómica, molecular o agregada. Como una transformación química va acompañada de un cambio en uno o más de estos tipos de estructuras, invariablemente va acompañada de un aumento o disminución de la energía de las sustancias involucradas. Parte de la energía se transfiere entre el entorno y los reactivos de la reacción en forma de calor o luz; por lo tanto, los productos de una reacción pueden tener más o menos energía que los reactivos.
Se dice que una reacción es exergónica si el estado final es más bajo en la escala de energía que el estado inicial; en el caso de reacciones endergónicas, la situación es inversa. Se dice que una reacción es exotérmica si la reacción libera calor a los alrededores; en el caso de reacciones endotérmicas, la reacción absorbe calor del entorno.
Solo existen estados limitados de energía posible para electrones, átomos y moléculas. Estos están determinados por las reglas de la mecánica cuántica, que requieren la cuantificación de la energía de un sistema vinculado. Se dice que los átomos / moléculas en un estado de mayor energía están excitados. Las moléculas / átomos de sustancia en un estado de energía excitado a menudo son mucho más reactivos; es decir, más susceptible a las reacciones químicas.
La fase de una sustancia está invariablemente determinada por su energía y la energía de su entorno. Cuando las fuerzas intermoleculares de una sustancia son tales que la energía del entorno no es suficiente para superarlas, se produce en una fase más ordenada, como líquido o sólido, como es el caso del agua (H 2 O); un líquido a temperatura ambiente porque sus moléculas están unidas por enlaces de hidrógeno. Mientras que el sulfuro de hidrógeno (H 2 S) es un gas a temperatura ambiente y presión estándar, ya que sus moléculas están unidas por interacciones dipolo-dipolo más débiles.
La transferencia de energía de una sustancia química a otra depende del tamaño de los cuantos de energía emitidos por una sustancia. Sin embargo, la energía térmica a menudo se transfiere más fácilmente de casi cualquier sustancia a otra porque los fonones responsables de los niveles de energía vibratoria y rotacional en una sustancia tienen mucha menos energía que los fotones invocados para la transferencia de energía electrónica. Por lo tanto, debido a que los niveles de energía vibratoria y rotacional están más próximos que los niveles de energía electrónica, el calor se transfiere más fácilmente entre las sustancias en relación con la luz u otras formas de energía electrónica. Por ejemplo, la radiación electromagnética ultravioleta no se transfiere con tanta eficacia de una sustancia a otra como la energía térmica o eléctrica.
La existencia de niveles de energía característicos para diferentes sustancias químicas es útil para su identificación mediante el análisis de líneas espectrales. Diferentes tipos de espectros se usan a menudo en espectroscopía química, por ejemplo, IR, microondas, RMN, ESR, etc. La espectroscopía también se usa para identificar la composición de objetos remotos, como estrellas y galaxias distantes, mediante el análisis de sus espectros de radiación.
El término energía química a menudo se usa para indicar el potencial de una sustancia química para experimentar una transformación a través de una reacción química o para transformar otras sustancias químicas.
Reacción
Cuando una sustancia química se transforma como resultado de su interacción con otra sustancia o con energía, se dice que ha ocurrido una reacción química. Una reacción química es, por lo tanto, un concepto relacionado con la "reacción" de una sustancia cuando entra en contacto íntimo con otra, ya sea como una mezcla o una solución; exposición a alguna forma de energía, o ambas cosas. Resulta en un intercambio de energía entre los componentes de la reacción y con el entorno del sistema, que pueden diseñarse recipientes, a menudo cristalería de laboratorio.
Las reacciones químicas pueden dar como resultado la formación o disociación de las moléculas, es decir, las moléculas que se separan para formar dos o más moléculas más pequeñas, o la reorganización de los átomos dentro de las moléculas o entre ellas. Las reacciones químicas generalmente implican la fabricación o ruptura de enlaces químicos. Oxidación, reducción, disociación, neutralización ácido-base y reordenamiento molecular son algunos de los tipos de reacciones químicas comúnmente utilizados.
Una reacción química se puede representar simbólicamente a través de una ecuación química. Mientras que en una reacción química no nuclear el número y el tipo de átomos en ambos lados de la ecuación son iguales, para una reacción nuclear esto solo es cierto para las partículas nucleares. protones y neutrones.
La secuencia de pasos en los que la reorganización de los enlaces químicos puede estar teniendo lugar en el curso de una reacción química se llama su mecanismo. Se puede prever que una reacción química tenga lugar en varios pasos, cada uno de los cuales puede tener una velocidad diferente. Muchos productos intermedios de reacción con estabilidad variable pueden por lo tanto ser considerados durante el curso de una reacción. Los mecanismos de reacción se proponen para explicar la cinética y la mezcla de producto relativa de una reacción. Muchos químicos físicos se especializan en explorar y proponer los mecanismos de varias reacciones químicas. Varias reglas empíricas, como las reglas de Woodward-Hoffmann a menudo son útiles al proponer un mecanismo para una reacción química.
Según el libro de oro IUPAC, una reacción química es "un proceso que resulta en la interconversión de especies químicas". Por consiguiente, una reacción química puede ser una reacción elemental o una reacción gradual. Se hace una advertencia adicional, ya que esta definición incluye casos en los que la interconversión de confórmeros es experimentalmente observable. Tales reacciones químicas detectables normalmente involucran conjuntos de entidades moleculares como lo indica esta definición, pero a menudo es conceptualmente conveniente usar el término también para cambios que involucran entidades moleculares únicas (es decir, "eventos químicos microscópicos").
Iones y sales
Un ion es una especie cargada, un átomo o una molécula, que ha perdido o ganado uno o más electrones. Cuando un átomo pierde un electrón y, por lo tanto, tiene más protones que electrones, el átomo es un ion o catión con carga positiva. Cuando un átomo gana un electrón y, por lo tanto, tiene más electrones que protones, el átomo es un ion o anión cargado negativamente. Los cationes y aniones pueden formar una red cristalina de sales neutras, como los iones Na y Cl que forman cloruro de sodio o NaCl. Los ejemplos de iones poliatómicos que no se dividen durante las reacciones ácido-base son hidróxido (OH) y fosfato (PO 4 ).
El plasma está compuesto de materia gaseosa que ha sido completamente ionizada, generalmente a través de altas temperaturas.
Acidez y basicidad
Una sustancia a menudo puede clasificarse como un ácido o una base. Existen varias teorías diferentes que explican el comportamiento ácido-base. La más simple es la teoría de Arrhenius, que establece que un ácido es una sustancia que produce iones de hidronio cuando se disuelve en agua, y una base es aquella que produce iones de hidróxido cuando se disuelve en agua. Según la teoría del ácido base de Brønsted-Lowry, los ácidos son sustancias que donan un ion de hidrógeno positivo a otra sustancia en una reacción química; por extensión, una base es la sustancia que recibe ese ion hidrógeno.
Una tercera teoría común es la teoría de base ácida de Lewis, que se basa en la formación de nuevos enlaces químicos. La teoría de Lewis explica que un ácido es una sustancia que es capaz de aceptar un par de electrones de otra sustancia durante el proceso de formación del enlace, mientras que una base es una sustancia que puede proporcionar un par de electrones para formar un nuevo enlace. De acuerdo con esta teoría, las cosas cruciales que se intercambian son cargos. Hay varias otras formas en que una sustancia puede clasificarse como un ácido o una base, como es evidente en la historia de este concepto.
La fuerza del ácido se mide comúnmente por dos métodos. Una medida, basada en la definición de acidez de Arrhenius, es el pH, que es una medida de la concentración de ion hidronio en una solución, expresada en una escala logarítmica negativa. Por lo tanto, las soluciones que tienen un pH bajo tienen una alta concentración de ion hidronio, y se puede decir que son más ácidas. La otra medida, basada en la definición de Brønsted-Lowry, es la constante de disociación ácida (K a ), que mide la capacidad relativa de una sustancia para actuar como un ácido bajo la definición de ácido de Brønsted-Lowry. Es decir, las sustancias con una K a más alta son más propensas a donar iones de hidrógeno en reacciones químicas que las que tienen valores más bajos de K a .
Redox
Redox ( rojo uction- buey idation) reacciones incluyen todas las reacciones químicas en las que los átomos tienen su estado de oxidación cambió por cualquiera de electrones ganando (reducción) o electrones que pierden (oxidación). Se dice que las sustancias que tienen la capacidad de oxidar otras sustancias son oxidantes y se conocen como agentes oxidantes, oxidantes u oxidantes. Un oxidante elimina electrones de otra sustancia. Del mismo modo, se dice que las sustancias que tienen la capacidad de reducir otras sustancias son reductivas y se conocen como agentes reductores, reductores o reductores.
Un reductor transfiere electrones a otra sustancia y, por lo tanto, se oxida a sí mismo. Y debido a que "dona" electrones, también se llama donador de electrones. La oxidación y la reducción se refieren adecuadamente a un cambio en el número de oxidación: la transferencia real de electrones puede que nunca ocurra. Por lo tanto, la oxidación se define mejor como un aumento en el número de oxidación, y la reducción como una disminución en el número de oxidación.
Equilibrio
Aunque el concepto de equilibrio es ampliamente utilizado en todas las ciencias, en el contexto de la química, surge cada vez que son posibles varios estados diferentes de la composición química, como por ejemplo, en una mezcla de varios compuestos químicos que pueden reaccionar entre sí, o cuando una sustancia puede estar presente en más de un tipo de fase.
Un sistema de sustancias químicas en equilibrio, a pesar de tener una composición inmutable, a menudo no es estático; las moléculas de las sustancias continúan reaccionando entre sí dando lugar a un equilibrio dinámico. Por lo tanto, el concepto describe el estado en el que los parámetros tales como la composición química permanecen sin cambios a lo largo del tiempo.
Leyes químicas
Las reacciones químicas se rigen por ciertas leyes, que se han convertido en conceptos fundamentales de la química. Algunos de ellos son:
- La ley de Avogadro
- Ley Beer-Lambert
- La ley de Boyle (1662, que relaciona la presión y el volumen)
- La ley de Charles (1787, que relaciona el volumen y la temperatura)
- Las leyes de difusión de Fick
- La ley de Gay-Lussac (1809, que relaciona la presión y la temperatura)
- El principio de Le Chatelier
- La ley de Henry
- La ley de Hess
- La ley de conservación de la energía conduce a los conceptos importantes de equilibrio, termodinámica y cinética.
- La ley de conservación de la masa continúa siendo conservada en sistemas aislados, incluso en la física moderna. Sin embargo, la relatividad especial muestra que debido a la equivalencia energía-masa, siempre que la "energía" no material (calor, luz, energía cinética) se elimine de un sistema no aislado, se perderá algo de masa con él. Las altas pérdidas de energía dan como resultado la pérdida de cantidades de masa que se pueden pesar, un tema importante en la química nuclear.
- Ley de composición definida, aunque en muchos sistemas (notablemente biomacromoléculas y minerales) las relaciones tienden a requerir grandes números, y con frecuencia se representan como una fracción.
- Ley de proporciones múltiples
- La ley de Raoult
Historia
De definición
La definición de química ha cambiado con el tiempo, a medida que los nuevos descubrimientos y teorías se agregan a la funcionalidad de la ciencia. El término "química", en opinión del célebre científico Robert Boyle en 1661, significó el tema de los principios materiales de los cuerpos mixtos. En 1663, el químico Christopher Glaser describió la "química" como un arte científico, mediante el cual uno aprende a disolver los cuerpos, y extraer de ellos las diferentes sustancias en su composición, y cómo unirlos de nuevo, y exaltarlos a una perfección superior.
La definición de 1730 de la palabra "química", tal como la usó Georg Ernst Stahl, significó el arte de resolver cuerpos mixtos, compuestos o agregados en sus principios; y de componer tales cuerpos a partir de esos principios. En 1837, Jean-Baptiste Dumas consideró la palabra "química" para referirse a la ciencia relacionada con las leyes y los efectos de las fuerzas moleculares. Esta definición evolucionó aún más hasta que, en 1947, llegó a significar la ciencia de las sustancias: su estructura, sus propiedades y las reacciones que las transforman en otras sustancias, una caracterización aceptada por Linus Pauling. Más recientemente, en 1998, el profesor Raymond Chang amplió la definición de "química" para referirse al estudio de la materia y los cambios que sufre.
De disciplina
Las primeras civilizaciones, como los egipcios babilonios, los indios acumularon conocimiento práctico sobre las artes de la metalurgia, la cerámica y los tintes, pero no desarrollaron una teoría sistemática.
Una hipótesis química básica surgió por primera vez en la Grecia clásica con la teoría de los cuatro elementos tal como Aristóteles propuso definitivamente que el fuego, el aire, la tierra y el agua eran los elementos fundamentales a partir de los cuales todo se forma como una combinación. El atomismo griego data del 440 aC, surgiendo en obras de filósofos como Demócrito y Epicuro. En 50 aC, el filósofo romano Lucrecio amplió la teoría en su libro De rerum natura (Sobre la naturaleza de las cosas). A diferencia de los conceptos modernos de la ciencia, el atomismo griego era de naturaleza puramente filosófica, con poca preocupación por las observaciones empíricas y sin interés por los experimentos químicos.
En el mundo helenístico, el arte de la alquimia primero prolifera, mezclando la magia y el ocultismo en el estudio de las sustancias naturales con el objetivo final de transmutar los elementos en oro y descubrir el elixir de la vida eterna. El trabajo, particularmente el desarrollo de la destilación, continuó en el período bizantino temprano, siendo el practicante más famoso el zósimo griego-egipcio del siglo IV de Panópolis. La alquimia continuó desarrollándose y practicándose en todo el mundo árabe después de las conquistas musulmanas, y desde allí, y desde los remanentes bizantinos, se difundió en la Europa medieval y renacentista a través de traducciones latinas. Algunos químicos musulmanes influyentes, Abū al-Rayhān al-Bīrūnī, Avicenna y Al-Kindi refutaron las teorías de la alquimia, particularmente la teoría de la transmutación de metales;
El desarrollo del método científico moderno fue lento y arduo, pero un temprano método científico para la química comenzó a surgir entre los primeros químicos musulmanes, comenzando con el químico persa-árabe del siglo IX Jābir ibn Hayyān (conocido como "Geber" en Europa), que es a veces referido como "el padre de la química". Introdujo un enfoque sistemático y experimental de la investigación científica basada en el laboratorio, en contraste con los antiguos alquimistas griegos y egipcios, cuyas obras fueron en gran parte alegórica y, a menudo ininteligible. Bajo la influencia de los nuevos métodos empíricos propuestos por Sir Francis Bacon y otros, un grupo de químicos en Oxford, Robert Boyle, Robert Hooke y John Mayow comenzó a remodelar las viejas tradiciones alquímicas en una disciplina científica. El Chymist Escéptico donde se hace la diferenciación entre las afirmaciones de la alquimia y los descubrimientos científicos empíricos de la nueva química. Formuló la ley de Boyle, rechazó los "cuatro elementos" clásicos y propuso una alternativa mecanicista de átomos y reacciones químicas que podrían estar sujetos a un experimento riguroso.
La teoría del flogisto (una sustancia en la raíz de toda la combustión) fue propuesta por el alemán Georg Ernst Stahl a principios del siglo XVIII y fue anulada por el químico francés Antoine Lavoisier, el análogo químico de Newton en el siglo pasado. física; quién hizo más que cualquier otro para establecer la nueva ciencia en la base teórica apropiada, dilucidando el principio de la conservación de la masa y desarrollando un nuevo sistema de la nomenclatura química usada a este día.
Antes de su trabajo, sin embargo, se habían hecho muchos descubrimientos importantes, específicamente relacionados con la naturaleza del "aire" que se descubrió que estaba compuesto de muchos gases diferentes. El químico escocés Joseph Black (el primer químico experimental) y el holandés JB van Helmont descubrieron el dióxido de carbono, o lo que Black llamó "aire fijo" en 1754; Henry Cavendish descubrió el hidrógeno y dilucidó sus propiedades y Joseph Priestley e, independientemente, Carl Wilhelm Scheele aisló el oxígeno puro.
El científico inglés John Dalton propuso la teoría moderna de los átomos; que todas las sustancias están compuestas de 'átomos' indivisibles de materia y que átomos diferentes tienen pesos atómicos variables.
El desarrollo de la teoría electroquímica de combinaciones químicas ocurrió a principios del siglo XIX como resultado del trabajo de dos científicos en particular, JJ Berzelius y Humphry Davy, hecho posible por la invención previa de la pila voltaica de Alessandro Volta. Davy descubrió nueve elementos nuevos, incluidos los metales alcalinos, al extraerlos de sus óxidos con corriente eléctrica.
El británico William Prout propuso por primera vez ordenar todos los elementos por su peso atómico, ya que todos los átomos tenían un peso que era un múltiplo exacto del peso atómico del hidrógeno. JAR Newlands ideó una tabla inicial de elementos, que luego fue desarrollada en la moderna tabla periódica de elementos en la década de 1860 por Dmitri Mendeleev e independientemente por otros científicos como Julius Lothar Meyer. Los gases inertes, más tarde llamados gases nobles, fueron descubiertos por William Ramsay en colaboración con Lord Rayleigh a fines de siglo, completando así la estructura básica de la tabla.
A comienzos del siglo XX, los fundamentos teóricos de la química finalmente se comprendieron gracias a una serie de descubrimientos notables que tuvieron éxito al explorar y descubrir la naturaleza misma de la estructura interna de los átomos. En 1897, JJ Thomson de la Universidad de Cambridge descubrió el electrón y poco después el científico francés Becquerel y la pareja Pierre y Marie Curie investigaron el fenómeno de la radioactividad. En una serie de experimentos de dispersión pioneros, Ernest Rutherford de la Universidad de Manchester descubrió la estructura interna del átomo y la existencia del protón, clasificó y explicó los diferentes tipos de radiactividad y transmutó con éxito el primer elemento bombardeando nitrógeno con partículas alfa.
Su trabajo sobre la estructura atómica fue mejorado por sus estudiantes, el físico danés Niels Bohr y Henry Moseley. La teoría electrónica de los enlaces químicos y los orbitales moleculares fue desarrollada por los científicos estadounidenses Linus Pauling y Gilbert N. Lewis.
El año 2011 fue declarado por las Naciones Unidas como el Año Internacional de la Química. Fue una iniciativa de la Unión Internacional de Química Pura y Aplicada, y de la Organización de las Naciones Unidas para la Educación, la Ciencia y la Cultura e involucra sociedades químicas, académicos e instituciones de todo el mundo y se basó en iniciativas individuales para organizar actividades locales y regionales.
La química orgánica fue desarrollada por Justus von Liebig y otros, siguiendo la síntesis de urea de Friedrich Wöhler que demostró que los organismos vivos eran, en teoría, reducibles a la química. Otros avances cruciales del siglo XIX fueron; una comprensión de la vinculación de valencia (Edward Frankland en 1852) y la aplicación de la termodinámica a la química (JW Gibbs y Svante Arrhenius en la década de 1870).
Práctica
Subdisciplinas
La química generalmente se divide en varias subdisciplinas principales. También hay varios campos principales de química interdisciplinaria y más especializados.
- La química analítica es el análisis de muestras de materiales para comprender su composición y estructura química. La química analítica incorpora métodos experimentales estandarizados en química. Estos métodos se pueden usar en todas las subdisciplinas de la química, excluyendo la química puramente teórica.
- La bioquímica es el estudio de los productos químicos, las reacciones químicas y las interacciones químicas que tienen lugar en los organismos vivos. La bioquímica y la química orgánica están estrechamente relacionadas, como en química médica o neuroquímica. La bioquímica también está asociada con la biología molecular y la genética.
- La química inorgánica es el estudio de las propiedades y reacciones de los compuestos inorgánicos. La distinción entre disciplinas orgánicas e inorgánicas no es absoluta y existe mucha superposición, sobre todo en la subdisciplina de la química organometálica.
- La química de los materiales es la preparación, caracterización y comprensión de sustancias con una función útil. El campo es una nueva amplitud de estudio en programas de postgrado, e integra elementos de todas las áreas clásicas de la química con un enfoque en cuestiones fundamentales que son exclusivas de los materiales. Los sistemas primarios de estudio incluyen la química de las fases condensadas (sólidos, líquidos, polímeros) y las interfaces entre las diferentes fases.
- Neuroquímica es el estudio de neuroquímicos; incluyendo transmisores, péptidos, proteínas, lípidos, azúcares y ácidos nucleicos; sus interacciones y los roles que desempeñan en la formación, el mantenimiento y la modificación del sistema nervioso.
- La química nuclear es el estudio de cómo las partículas subatómicas se unen y forman núcleos. La transmutación moderna es un gran componente de la química nuclear, y la tabla de nucleidos es un resultado importante y una herramienta para este campo.
- La química orgánica es el estudio de la estructura, propiedades, composición, mecanismos y reacciones de los compuestos orgánicos. Un compuesto orgánico se define como cualquier compuesto basado en un esqueleto de carbono.
- La química física es el estudio de la base física y fundamental de los sistemas y procesos químicos. En particular, la energía y la dinámica de tales sistemas y procesos son de interés para los químicos físicos. Las áreas de estudio importantes incluyen la termodinámica química, la cinética química, la electroquímica, la mecánica estadística, la espectroscopia y, más recientemente, la astroquímica. La química física tiene una gran superposición con la física molecular. La química física implica el uso de cálculo infinitesimal para derivar ecuaciones. Por lo general, se asocia con la química cuántica y la química teórica. La química física es una disciplina distinta de la física química, pero, una vez más, existe una superposición muy fuerte.
- La química teórica es el estudio de la química a través del razonamiento teórico fundamental (generalmente dentro de las matemáticas o la física). En particular, la aplicación de la mecánica cuántica a la química se llama química cuántica. Desde el final de la Segunda Guerra Mundial, el desarrollo de las computadoras ha permitido un desarrollo sistemático de la química computacional, que es el arte de desarrollar y aplicar programas informáticos para resolver problemas químicos. La química teórica tiene una gran superposición con la física de la materia condensada (teórica y experimental) y la física molecular.
Otras disciplinas dentro de la química se agrupan tradicionalmente por el tipo de materia que se estudia o el tipo de estudio. Estos incluyen la química inorgánica, el estudio de la materia inorgánica; química orgánica, el estudio de la materia orgánica (a base de carbono); bioquímica, el estudio de sustancias encontradas en organismos biológicos; la química física, el estudio de procesos químicos utilizando conceptos físicos como la termodinámica y la mecánica cuántica; y química analítica, el análisis de muestras de materiales para comprender su composición y estructura química. En los últimos años han surgido muchas disciplinas más especializadas, por ejemplo, neuroquímica, el estudio químico del sistema nervioso (ver subdisciplinas).
Otros campos incluyen agroquímica, astroquímica (y cosmoquímica), química atmosférica, ingeniería química, biología química, quimio-informática, electroquímica, química ambiental, femtoquímica, química del sabor, química de flujo, geoquímica, química verde, histoquímica, historia de la química, química de hidrogenación. , inmunoquímica, química marina, ciencia de materiales, química matemática, mecanoquímica, química médica, biología molecular, mecánica molecular, nanotecnología, química de productos naturales, enología, química organometálica, petroquímica, farmacología, fotoquímica, química orgánica física, fitoquímica, química de polímeros, radioquímica , química de estado sólido, sonoquímica, química supramolecular, química de superficie, química sintética, termoquímica y muchos otros.
Industria
La industria química representa una actividad económica importante en todo el mundo. Los principales 50 principales productores de productos químicos en 2013 tuvieron ventas de 980.500 millones de dólares con un margen de beneficio del 10,3%.
Sociedades profesionales
- sociedad Química Americana
- Sociedad Americana de Neuroquímica
- Instituto químico de Canadá
- Sociedad Química del Perú
- Unión internacional de Química Pura Aplicada
- Royal Australian Chemical Institute
- Sociedad química real de los Países Bajos
- Real Sociedad de Química
- Sociedad de industria química
- Asociación Mundial de Químicos Teóricos y Computacionales
- Lista de sociedades de química