Cobre
Definición
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Apariencia | brillo metálico rojo anaranjado | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atómico estándar ( A r, estándar) | 63.546 (3) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cobre en la tabla periódica | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número atómico ( Z ) | 29 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo | grupo 11 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Período | período 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoría de elemento | metal de transición | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bloquear | d-block | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electronica | [Ar] 3d 4s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Electrones por caparazón | 2, 8, 18, 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase en STP | sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusion | 1357,77 K (1084,62 ° C, 1984,32 ° F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 2835 K (2562 ° C, 4643 ° F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad (cerca de rt ) | 8.96 g / cm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| cuando es líquido (en mp ) | 8.02 g / cm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusión | 13.26 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de vaporización | 300,4 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidad de calor molar | 24.440 J / (mol • K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Presión de vapor
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidación | -2, +1, +2 , +3, +4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | Escala de Pauling: 1.90 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energías de ionización |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico | empírico: 128 p. m. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 132 ± 4 p. M. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio Van der Waals | 140 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelánea | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | centrado en la cara cúbico (fcc) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad de la varilla delgada de sonido | (recocido) 3810 m / s (a rt ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Expansión térmica | 16.5 μm / (m • K) (a 25 ° C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 401 W / (m • K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistividad electrica | 16,78 nΩ • m (a 20 ° C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | diamagnético | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Susceptibilidad magnética | -5.46 • 10 cm / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| El módulo de Young | 110-128 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de corte | 48 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de volumen | 140 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relación de Poisson | 0.34 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 3.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Vickers | 343-369 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 235-878 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número CAS | 7440-50-8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombrando | después de Chipre, principal lugar de minería en la época romana (Cyprium ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | Medio Oriente (9000 aC) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Principales isótopos de cobre | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El cobre es un elemento químico con el símbolo Cu (del latín: cuprum ) y el número atómico 29. Es un metal blando, maleable y dúctil con una conductividad térmica y eléctrica muy alta. Una superficie recién expuesta de cobre puro tiene un color naranja rojizo. El cobre se utiliza como conductor de calor y electricidad, como material de construcción y como componente de varias aleaciones metálicas, como la plata esterlina utilizada en joyería, el cuproníquel utilizado para fabricar accesorios y monedas marinas, y el constantan utilizado en galgas extensométricas y termopares para medir la temperatura
El cobre es uno de los pocos metales que pueden ocurrir en la naturaleza en una forma metálica directamente utilizable (metales nativos). Esto condujo a un uso humano muy temprano en varias regiones, desde c. 8000 aC Miles de años después, fue el primer metal fundido a partir de minerales de sulfuro de cobre, c. 5000 aC, el primer metal en ser moldeado en un molde, c. 4000 aC y el primer metal en alearse a propósito con otro metal, estaño, para crear bronce, c. 3500 aC
En la época romana, el cobre se extraía principalmente en Chipre, el origen del nombre del metal, de aes сyprium (metal de Chipre), que más tarde se corrompió a сuprum , de donde provienen las palabras cobre (inglés), cuivre (francés), cobre (Español), Koper (holandés) y Kupfer (alemán) son todos derivados.
Los compuestos comúnmente encontrados son sales de cobre (II), que a menudo imparten colores azules o verdes a minerales tales como azurita, malaquita y turquesa, y se han usado ampliamente e históricamente como pigmentos.
El cobre utilizado en los edificios, generalmente para techos, se oxida para formar un cardenillo verde (o pátina). El cobre a veces se usa en el arte decorativo, tanto en su forma de metal elemental como en compuestos como pigmentos. Los compuestos de cobre se usan como agentes bacteriostáticos, fungicidas y conservantes de la madera.
El cobre es esencial para todos los organismos vivos como un mineral dietético traza porque es un componente clave del complejo enzimático respiratorio citocromo c oxidasa. En moluscos y crustáceos, el cobre es un constituyente de la hemocianina del pigmento sanguíneo, reemplazado por la hemoglobina complejada con hierro en peces y otros vertebrados. En los humanos, el cobre se encuentra principalmente en el hígado, los músculos y los huesos. El cuerpo adulto contiene entre 1.4 y 2.1 mg de cobre por kilogramo de peso corporal.
Características
Físico
El cobre, la plata y el oro están en el grupo 11 de la tabla periódica; estos tres metales tienen un electrón s-orbital en la parte superior de una carcasa de d-electrón llena y se caracterizan por una alta ductilidad y conductividad eléctrica y térmica. Los d-shells llenos en estos elementos contribuyen poco a las interacciones interatómicas, que están dominadas por los electrones s a través de enlaces metálicos. A diferencia de los metales con d-shells incompletos, los enlaces metálicos en el cobre carecen de carácter covalente y son relativamente débiles. Esta observación explica la baja dureza y alta ductilidad de cristales individuales de cobre. A escala macroscópica, la introducción de defectos extendidos a la red cristalina, tales como los límites del grano, dificulta el flujo del material bajo tensión aplicada, aumentando así su dureza. Por esta razón,
La suavidad del cobre explica en parte su alta conductividad eléctrica (59.6 × 10 S / m) y su alta conductividad térmica, la segunda más alta (por debajo de la plata) entre los metales puros a temperatura ambiente. Esto se debe a que la resistividad al transporte de electrones en los metales a temperatura ambiente se origina principalmente por la dispersión de electrones en las vibraciones térmicas de la red, que son relativamente débiles en un metal blando. La densidad de corriente máxima permisible del cobre al aire libre es de aproximadamente 3.1 × 10 A / m de área de sección transversal, por encima de la cual comienza a calentar excesivamente.
El cobre es uno de los pocos elementos metálicos con un color natural que no sea el gris o el plateado. El cobre puro es rojo anaranjado y adquiere un deslustre rojizo cuando se expone al aire. El color característico del cobre es el resultado de las transiciones electrónicas entre los cartuchos atómicos 4s llenos de 3D y medio vacíos: la diferencia de energía entre estos caparazones corresponde a la luz naranja.
Al igual que con otros metales, si el cobre entra en contacto con otro metal, se producirá corrosión galvánica.
Químico
El cobre no reacciona con el agua, pero reacciona lentamente con el oxígeno atmosférico para formar una capa de óxido de cobre marrón oscuro que, a diferencia del óxido que se forma sobre el hierro en el aire húmedo, protege el metal subyacente de la corrosión posterior (pasivación). Una capa verde de cardenillo (carbonato de cobre) se puede ver a menudo en antiguas estructuras de cobre, como el techado de muchos edificios antiguos y la Estatua de la Libertad. Copper se deslustra cuando se expone a algunos compuestos de azufre, con los que reacciona para formar diversos sulfuros de cobre .
Isótopos
Hay 29 isótopos de cobre. Cu y Cu son estables, con Cu que comprende aproximadamente el 69% de cobre natural; ambos tienen un giro de / 2 . Los otros isótopos son radiactivos, siendo el Cu el más estable con una vida media de 61.83 horas. Se han caracterizado siete isótopos metaestables; Cu es el más longevo con una vida media de 3.8 minutos. Los isótopos con un número de masa superior a 64 decaen por β, mientras que aquellos con un número de masa inferior a 64 se desintegran por β. Cu, que tiene una vida media de 12,7 horas, se descompone en ambos sentidos.
Cu y Cu tienen aplicaciones significativas. Cu se usa en Cu-PTSM como un trazador radiactivo para la tomografía por emisión de positrones.
Ocurrencia
El cobre se produce en estrellas masivas y está presente en la corteza terrestre en una proporción de aproximadamente 50 partes por millón (ppm). En la naturaleza, el cobre se encuentra en una variedad de minerales, incluyendo cobre nativo, sulfuros de cobre como calcopirita, bornita, digenita, covelita y calcocita, sulfosaltos de cobre como tetraedita-tennantita y enargita, carbonatos de cobre como azurita y malaquita, y como óxidos de cobre (I) o cobre (II) tales como cuprita y tenorita, respectivamente. La masa más grande de cobre elemental descubierta pesaba 420 toneladas y se encontró en 1857 en la península Keweenaw en Michigan, EE. UU. El cobre nativo es un policristal, con el cristal único más grande jamás descrito que mide 4.4 × 3.2 × 3.2 cm.
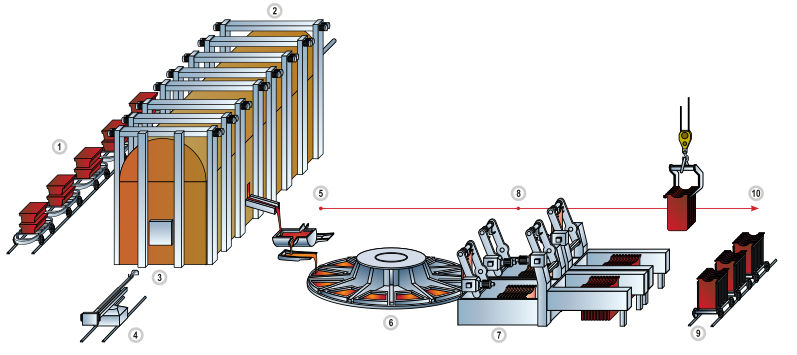
Producción
La mayoría del cobre se extrae o extrae como sulfuros de cobre de grandes minas a cielo abierto en depósitos de pórfidos de cobre que contienen de 0.4 a 1.0% de cobre. Los sitios incluyen Chuquicamata, en Chile, Bingham Canyon Mine, en Utah, Estados Unidos, y El Chino Mine, en Nuevo México, Estados Unidos. Según British Geological Survey, en 2005, Chile era el principal productor de cobre con al menos un tercio de la participación mundial, seguido de Estados Unidos, Indonesia y Perú. El cobre también se puede recuperar a través del proceso de lixiviación in situ. Varios sitios en el estado de Arizona se consideran los principales candidatos para este método. La cantidad de cobre en uso está aumentando y la cantidad disponible es apenas suficiente para permitir que todos los países alcancen niveles de uso en el mundo desarrollado.
Reservas
El cobre ha estado en uso al menos 10.000 años, pero más del 95% de todo el cobre extraído y fundido se extrajo desde 1900, y más de la mitad se extrajo en los últimos 24 años. Al igual que con muchos recursos naturales, la cantidad total de cobre en la Tierra es enorme, con alrededor de 10 toneladas en el kilómetro superior de la corteza terrestre, que es de aproximadamente 5 millones de años al ritmo actual de extracción. Sin embargo, solo una pequeña fracción de estas reservas es económicamente viable con los precios y tecnologías actuales. Las estimaciones de las reservas de cobre disponibles para la minería varían de 25 a 60 años, dependiendo de las suposiciones básicas, como la tasa de crecimiento. El reciclaje es una fuente importante de cobre en el mundo moderno. Debido a estos y otros factores, el futuro de la producción y el suministro de cobre es tema de mucho debate, incluido el concepto de cobre pico,
Históricamente, el precio del cobre ha sido inestable y su precio aumentó desde el mínimo de 60 años de US $ 0,60 / lb (US $ 1,32 / kg) en junio de 1999 a US $ 3,75 por libra (US $ 8,27 / kg) en mayo de 2006. Bajó a US $ 2,40. / lb ($ 5,29 / kg) en febrero de 2007, luego rebotó a $ 3.50 / lb ($ 7,71 / kg) en abril de 2007. En febrero de 2009, el debilitamiento de la demanda mundial y una fuerte caída de los precios de los productos básicos desde los máximos del año anterior / lb ($ 3.32 / kg).
Métodos
La concentración de cobre en minerales promedia solo 0.6%, y la mayoría de los minerales comerciales son sulfuros, especialmente calcopirita (CuFeS 2 ), bornita (Cu 5 FeS 4 ) y, en menor medida, covellita (CuS) y calcocita (Cu 2 S) . Estos minerales se concentran a partir de minerales triturados hasta el nivel de 10-15% de cobre mediante flotación por espuma o biolixiviación. Calentar este material con sílice en la fusión instantánea elimina gran parte del hierro en forma de escoria. El proceso explota la mayor facilidad de convertir sulfuros de hierro en óxidos, que a su vez reaccionan con la sílice para formar la escoria de silicato que flota sobre la masa calentada. El cobre mate resultante , que consiste en Cu 2 S, se tuesta para convertir todos los sulfuros en óxidos:
- 2 Cu 2 S + 3 O 2 → 2 Cu 2 O + 2 SO 2
El óxido cuproso se convierte en cobre blister al calentar:
- 2 Cu 2 O → 4 Cu + O 2
El proceso mate de Sudbury convirtió solo la mitad del sulfuro en óxido y luego usó este óxido para eliminar el resto del azufre en forma de óxido. Luego se refinó electrolíticamente y se explotó el fango del ánodo para el platino y el oro que contenía. Este paso explota la reducción relativamente fácil de los óxidos de cobre a cobre metálico. Se pasa gas natural a través de la ampolla para eliminar la mayor parte del oxígeno restante y se realiza una electrorrefinería en el material resultante para producir cobre puro:
- Cu + 2 e → Cu
Reciclaje
Al igual que el aluminio, el cobre es reciclable sin pérdida de calidad, tanto del estado bruto como de los productos manufacturados. En volumen, el cobre es el tercer metal más reciclado después del hierro y el aluminio. Se estima que el 80% de todo el cobre extraído se sigue utilizando hoy en día. De acuerdo con el informe de Metal Stocks in Society del Panel de Recursos Internacionales, el stock per cápita mundial de cobre en uso en la sociedad es de 35-55 kg. Gran parte de esto ocurre en países más desarrollados (140-300 kg per cápita) en lugar de países menos desarrollados (30-40 kg per cápita).
El proceso de reciclaje del cobre es aproximadamente el mismo que se usa para extraer el cobre, pero requiere menos pasos. El cobre de desecho de alta pureza se funde en un horno y luego se reduce y se arroja en palanquillas e lingotes; La chatarra de baja pureza se refina mediante galvanoplastia en un baño de ácido sulfúrico.
Aleaciones
Numerosas aleaciones de cobre han sido formuladas, muchas de ellas con usos importantes. El latón es una aleación de cobre y zinc. El bronce generalmente se refiere a las aleaciones de cobre y estaño, pero puede referirse a cualquier aleación de cobre como el bronce de aluminio. El cobre es uno de los componentes más importantes de las soldaduras de oro y quilates de plata y quilates utilizadas en la industria de la joyería, que modifica el color, la dureza y el punto de fusión de las aleaciones resultantes. Algunas soldaduras sin plomo consisten en estaño aleado con una pequeña proporción de cobre y otros metales.
La aleación de cobre y níquel, llamada cuproníquel, se utiliza en monedas de baja denominación, a menudo para el revestimiento exterior. La moneda estadounidense de cinco centavos (actualmente denominada níquel ) consiste en un 75% de cobre y un 25% de níquel en una composición homogénea. La aleación de 90% de cobre y 10% de níquel, notable por su resistencia a la corrosión, se usa para diversos objetos expuestos al agua de mar, aunque es vulnerable a los sulfuros que a veces se encuentran en puertos y estuarios contaminados. Las aleaciones de cobre con aluminio (alrededor del 7%) tienen un color dorado y se usan en decoraciones. Shakudō es una aleación decorativa japonesa de cobre que contiene un bajo porcentaje de oro, típicamente 4-10%, que puede ser patinado a un color azul oscuro o negro.
Compuestos
El cobre forma una rica variedad de compuestos, generalmente con estados de oxidación +1 y +2, que a menudo se llaman cuprosos y cúpricos , respectivamente.
Compuestos binarios
Como con otros elementos, los compuestos más simples de cobre son compuestos binarios, es decir, aquellos que contienen solo dos elementos, los ejemplos principales son óxidos, sulfuros y haluros. Se conocen tanto óxidos cuprosos como cúpricos. Entre los numerosos sulfuros de cobre, los ejemplos importantes incluyen sulfuro de cobre (I) y sulfuro de cobre (II).
Se conocen haluros cuprosos (con cloro, bromo y yodo), así como haluros cúpricos con flúor, cloro y bromo. Los intentos de preparar yoduro de cobre (II) producen solo yoduro y yodo cuproso.
- 2 Cu + 4 I → 2 CuI + I 2
Química de coordinación
El cobre forma complejos de coordinación con ligandos. En solución acuosa, cobre (II) existe como [Cu (H 2 O) 6 ]. Este complejo exhibe la tasa de intercambio de agua más rápida (velocidad de unión y separación de ligandos de agua) para cualquier complejo de aquo de metal de transición. La adición de hidróxido de sodio acuoso provoca la precipitación de hidróxido de cobre (II) sólido azul claro. Una ecuación simplificada es:
- Cu + 2 OH → Cu (OH) 2
El amoniaco acuoso da como resultado el mismo precipitado. Al agregar exceso de amoníaco, el precipitado se disuelve, formando tetraamminecobre (II):
- Cu (H 2 O) 4 (OH) 2 + 4 NH 3 → [Cu (H 2 O) 2 (NH 3 ) 4 ] + 2 H 2 O + 2 OH
Muchos otros oxaniones forman complejos; estos incluyen acetato de cobre (II), nitrato de cobre (II) y carbonato de cobre (II). El sulfato de cobre (II) forma un pentahidrato cristalino azul, el compuesto de cobre más familiar en el laboratorio. Se usa en un fungicida llamado mezcla de Burdeos.
Los polioles, compuestos que contienen más de un grupo funcional de alcohol, generalmente interactúan con sales cúpricas. Por ejemplo, las sales de cobre se utilizan para evaluar azúcares reductores. Específicamente, utilizando el reactivo de Benedict y la solución de Fehling, la presencia del azúcar se señala por un cambio de color de Cu (II) azul a óxido de cobre (I) rojizo. El reactivo de Schweizer y los complejos relacionados con la etilendiamina y otras aminas disuelven la celulosa. Los aminoácidos forman complejos de quelatos muy estables con cobre (II). Existen muchas pruebas de químicos húmedos para iones de cobre, uno que involucra ferrocianuro de potasio, que da un precipitado marrón con sales de cobre (II).
Química de Organocopper
Los compuestos que contienen un enlace carbono-cobre se conocen como compuestos de organocobre. Son muy reactivos con el oxígeno para formar óxido de cobre (I) y tienen muchos usos en química. Se sintetizan tratando compuestos de cobre (I) con reactivos de Grignard, alquinos terminales o reactivos de organolitio; en particular, la última reacción descrita produce un reactivo Gilman. Estos pueden sufrir sustitución con haluros de alquilo para formar productos de acoplamiento; como tales, son importantes en el campo de la síntesis orgánica. El acetiluro de cobre (I) es muy sensible a los golpes pero es un intermediario en reacciones como el acoplamiento Cadiot-Chodkiewicz y el acoplamiento Sonogashira. La adición de conjugado a enonas y la carbocupración de alquinos también se puede lograr con compuestos de organocobre. El cobre (I) forma una variedad de complejos débiles con alquenos y monóxido de carbono,
Cobre (III) y cobre (IV)
El cobre (III) se encuentra con mayor frecuencia en los óxidos. Un ejemplo simple es el cuprato de potasio, KCuO 2 , un sólido azul-negro. Los compuestos de cobre (III) más ampliamente estudiados son los superconductores de cuprato. El óxido de itrio y bario de cobre (YBa 2 Cu 3 O 7 ) consiste en centros Cu (II) y Cu (III). Al igual que el óxido, el fluoruro es un anión altamente básico y se sabe que estabiliza los iones metálicos en estados de oxidación elevados. Se conocen fluoruros de cobre (III) e incluso cobre (IV), K
3 CuF
6 y Cs
2 CuF
6 , respectivamente.
3 CuF
6 y Cs
2 CuF
6 , respectivamente.
Algunas proteínas de cobre forman complejos oxo, que también tienen cobre (III). Con los tetrapéptidos, los complejos de cobre de color púrpura (III) se estabilizan mediante los ligandos de amida desprotonados.
Los complejos de cobre (III) también se encuentran como productos intermedios en reacciones de compuestos de organocobre. Por ejemplo, en la reacción de Kharasch-Sosnovsky.
Historia
Una línea de tiempo de cobre ilustra cómo el metal ha avanzado la civilización humana durante los últimos 11,000 años.
Historia prehistórica
Edad del cobre
El cobre se produce naturalmente como cobre metálico nativo y era conocido por algunas de las civilizaciones más antiguas de las que se tenga registro. La historia del uso del cobre data del 9000 aC en el Medio Oriente; un colgante de cobre se encontró en el norte de Iraq que data de 8700 aC. La evidencia sugiere que el oro y el hierro meteórico (pero no la fundición de hierro) fueron los únicos metales usados por los humanos antes del cobre. Se cree que la historia de la metalurgia del cobre sigue esta secuencia: primero, el trabajo en frío del cobre nativo, luego el recocido, la fundición y, finalmente, la fundición a la cera perdida. En el sudeste de Anatolia, las cuatro técnicas aparecen más o menos simultáneamente al comienzo del Neolítico c. 7500 aC
La fundición de cobre se inventó independientemente en diferentes lugares. Probablemente fue descubierto en China antes del 2800 aC, en América Central alrededor del 600 d. C., y en África Occidental alrededor del siglo IX o X. La fundición de inversión se inventó en el 4500-4000 aC en el sudeste asiático y la datación por carbono estableció la minería en Alderley Edge en Cheshire, Reino Unido, entre 2280 y 1890 aC Ötzi el Hombre de Hielo, un macho que data del 3300-3200 aC, fue encontrado con un hacha con una cabeza de cobre 99.7% puro; los altos niveles de arsénico en su cabello sugieren una participación en la fundición del cobre. La experiencia con el cobre ha ayudado al desarrollo de otros metales; en particular, la fundición de cobre condujo al descubrimiento de la fundición de hierro. La producción en el Old Copper Complex en Michigan y Wisconsin está fechada entre 6000 y 3000 antes de Cristo. Bronce natural, un tipo de cobre hecho de minerales ricos en silicio, arsénico,
Edad de Bronce
La aleación de cobre con estaño para fabricar bronce se practicó por primera vez unos 4000 años después del descubrimiento de la fundición de cobre, y alrededor de 2000 años después de que el "bronce natural" se hubiera convertido en uso general. Los artefactos de bronce de la cultura Vinča datan de 4500 aC. Artefactos sumerios y egipcios de aleaciones de cobre y bronce datan de 3000 aC La Edad del Bronce comenzó en el sudeste de Europa alrededor del 3700-3300 aC, en el noroeste de Europa alrededor del 2500 aC. Terminó con el comienzo de la Edad del Hierro, 2000-1000 aC en el Cercano Oriente, y 600 aC en el norte de Europa. La transición entre el período neolítico y la Edad del Bronce se denominaba antiguamente período calcolítico (piedra de cobre), cuando las herramientas de cobre se utilizaban con herramientas de piedra. El término ha caído gradualmente en desgracia porque en algunas partes del mundo, el calcolítico y el neolítico son colindantes en ambos extremos. Latón, una aleación de cobre y zinc, es de origen mucho más reciente. Era conocido por los griegos, pero se convirtió en un complemento importante del bronce durante el Imperio Romano.
Historia antigua y postclásica
En Grecia, el cobre se conoce con el nombre chalkos (χαλκός). Era un recurso importante para los romanos, griegos y otros pueblos antiguos. En la época romana, se la conocía como aes Cyprium , siendo aes el término genérico en latín para aleaciones de cobre y Cyprium de Chipre, donde se extraía mucho cobre. La frase se simplificó a cuprum , de ahí el cobre inglés . Afrodita (Venusin Roma) representó el cobre en la mitología y la alquimia debido a su belleza brillante y su uso antiguo en la producción de espejos; Chipre era sagrado para la diosa. Los siete cuerpos celestes conocidos por los antiguos se asociaron con los siete metales conocidos en la antigüedad, y Venus fue asignado al cobre.
El cobre se usó por primera vez en la antigua Gran Bretaña en el siglo III o II antes de Cristo. En América del Norte, la minería del cobre comenzó con el trabajo marginal de los nativos americanos. Se sabe que el cobre nativo se extrajo de los sitios en Isle Royale con herramientas de piedra primitivas entre 800 y 1600. La metalurgia del cobre estaba floreciendo en América del Sur, particularmente en el Perú alrededor del año 1000 DC. Las ornamentales funerarias de cobre del siglo XV han sido descubiertas, pero la producción comercial del metal no comenzó hasta principios del siglo XX.
El papel cultural del cobre ha sido importante, particularmente en moneda. Los romanos en los siglos VI al III aC usaron grumos de cobre como dinero. Al principio, el cobre se valoró, pero gradualmente la forma y el aspecto del cobre se hicieron más importantes. Julio César tenía sus propias monedas hechas de bronce, mientras que las monedas de Octavio Augusto César estaban hechas de aleaciones Cu-Pb-Sn. Con una producción anual estimada de alrededor de 15,000 t, las actividades de minería y fundición de cobre en Roma alcanzaron una escala sin igual hasta el momento de la Revolución Industrial; las provincias más intensamente minadas fueron las de Hispania, Chipre y Europa Central.
Las puertas del Templo de Jerusalén usaban bronce de Corinto tratado con dorado de agotamiento. El proceso fue más frecuente en Alejandría, donde se cree que comenzó la alquimia. En la India antigua, el cobre se utilizaba en la ciencia médica holística Ayurveda para instrumentos quirúrgicos y otros equipos médicos. Los antiguos egipcios (~ 2400 aC) usaban cobre para esterilizar heridas y agua potable, y luego para tratar dolores de cabeza, quemaduras y picazón.
Historia moderna
La Gran Montaña de Cobre fue una mina en Falun, Suecia, que funcionó desde el siglo X hasta 1992. Satisface dos tercios del consumo de cobre de Europa en el siglo XVII y ayudó a financiar muchas de las guerras de Suecia durante ese tiempo. Fue referido como el tesoro de la nación; Suecia tenía una moneda con respaldo de cobre.
El cobre se usa en techos, monedas y tecnología fotográfica conocida como daguerrotipo. El cobre se usó en la escultura del Renacimiento, y se usó para construir la Estatua de la Libertad; el cobre continúa siendo utilizado en la construcción de varios tipos. El revestimiento de cobre y el revestimiento de cobre se usaron ampliamente para proteger los cascos de los barcos bajo el agua, una técnica iniciada por el Almirantazgo británico en el siglo XVIII. La Norddeutsche Affinerie en Hamburgo fue la primera planta de galvanoplastia moderna, comenzando su producción en 1876. El científico alemán Gottfried Osann inventó la metalurgia del polvo en 1830 mientras determinaba la masa atómica del metal; alrededor de entonces se descubrió que la cantidad y el tipo de elemento de aleación (por ejemplo, estaño) al cobre afectaría los tonos de campana. Flash fundición fue desarrollado por Outokumpu en Finlandia y aplicado por primera vez en Harjavalta en 1949; el proceso de eficiencia energética representa el 50% de la producción primaria de cobre del mundo.
El Consejo Intergubernamental de Países Exportadores de Cobre, formado en 1967 por Chile, Perú, Zaire y Zambia, operaba en el mercado del cobre como lo hace la OPEP en petróleo, aunque nunca logró la misma influencia, particularmente porque es el segundo mayor productor, los Estados Unidos. , nunca fue miembro; fue disuelto en 1988
Aplicaciones
Las principales aplicaciones del cobre son cables eléctricos (60%), techos y plomería (20%) y maquinaria industrial (15%). El cobre se usa principalmente como metal puro, pero cuando se requiere una mayor dureza, se coloca en aleaciones tales como latón y bronce (5% del uso total). Durante más de dos siglos, la pintura de cobre se ha utilizado en cascos de barcos para controlar el crecimiento de plantas y mariscos. Una pequeña parte del suministro de cobre se usa para suplementos nutricionales y fungicidas en la agricultura. El mecanizado de cobre es posible, aunque se prefieren las aleaciones para una buena maquinabilidad en la creación de piezas complejas.
Alambre y cable
A pesar de la competencia de otros materiales, el cobre sigue siendo el conductor eléctrico preferido en casi todas las categorías de cableado eléctrico, excepto en la transmisión de energía eléctrica aérea, donde a menudo se prefiere el aluminio. El cable de cobre se utiliza en la generación de energía, transmisión de energía, distribución de energía, telecomunicaciones, circuitos electrónicos e innumerables tipos de equipos eléctricos. El cableado eléctrico es el mercado más importante para la industria del cobre. Esto incluye el cableado estructural de potencia, el cable de distribución de alimentación, el cable del dispositivo, el cable de comunicaciones, el cable y el cable automotriz y el cable magnético. Aproximadamente la mitad de todo el cobre extraído se usa para cables eléctricos y conductores de cables. Muchos dispositivos eléctricos dependen del cableado de cobre debido a su multitud de propiedades beneficiosas inherentes, como su alta conductividad eléctrica, resistencia a la tracción,
Durante un breve período desde fines de la década de 1960 hasta finales de la década de 1970, el cableado de cobre fue reemplazado por el cableado de aluminio en muchos proyectos de construcción de viviendas en Estados Unidos. El nuevo cableado estuvo implicado en una serie de incendios en el hogar y la industria volvió al cobre.
Los circuitos integrados y placas de circuitos impresos cuentan cada vez más con cobre en lugar de aluminio debido a su conductividad eléctrica superior; los disipadores de calor y los intercambiadores de calor usan cobre debido a sus propiedades superiores de disipación de calor. Electroimanes, tubos de vacío, tubos de rayos catódicos y magnetrones en hornos de microondas usan cobre, al igual que las guías de onda para la radiación de microondas.
Motor electrico
La conductividad superior del cobre mejora la eficiencia de los motores eléctricos. Esto es importante porque los motores y los sistemas accionados por motor representan entre el 43% y el 46% del consumo total de electricidad y el 69% de toda la electricidad utilizada por la industria. Aumentar la masa y la sección transversal del cobre en una bobina aumenta la eficiencia del motor. Los rotores de motor de cobre, una nueva tecnología diseñada para aplicaciones de motores donde el ahorro de energía son objetivos primordiales de diseño, permiten a los motores de inducción de uso general cumplir y superar los estándares de eficiencia premium de la Asociación Nacional de Fabricantes Eléctricos (NEMA).
Arquitectura
El cobre se ha utilizado desde la antigüedad como un material arquitectónico duradero, resistente a la corrosión y resistente a la intemperie. Techos, tapajuntas, canales de lluvia, bajantes, cúpulas, bóvedas, bóvedas y puertas se han hecho de cobre durante cientos o miles de años. El uso arquitectónico de cobre se ha expandido en los tiempos modernos para incluir revestimientos de paredes interiores y exteriores, juntas de expansión de edificios, blindaje de radiofrecuencia y productos antimicrobianos y decorativos para interiores, como barandillas, accesorios de baño y encimeras atractivos. Algunos de los otros beneficios importantes del cobre como material arquitectónico incluyen movimiento térmico bajo, peso liviano, protección contra rayos y reciclado.
La distintiva pátina verde natural del metal ha sido codiciada por arquitectos y diseñadores. La pátina final es una capa particularmente duradera que es altamente resistente a la corrosión atmosférica, protegiendo así el metal subyacente contra la intemperie adicional. Puede ser una mezcla de compuestos de carbonato y sulfato en diversas cantidades, dependiendo de las condiciones ambientales, como la lluvia ácida que contiene azufre. El cobre arquitectónico y sus aleaciones también pueden 'terminarse' para adquirir un aspecto, tacto o color particular. Los acabados incluyen tratamientos superficiales mecánicos, colorantes químicos y recubrimientos.
El cobre tiene excelentes propiedades de soldadura fuerte y soldadura fuerte y puede soldarse; los mejores resultados se obtienen con la soldadura por arco de gas y metal.
Aplicaciones de antibibición
El cobre es bioestático, lo que significa que las bacterias y muchas otras formas de vida no crecerán en él. Por esta razón, se ha utilizado durante mucho tiempo para revestir partes de barcos para proteger contra percebes y mejillones. Originalmente se utilizó puro, pero desde entonces ha sido reemplazado por Muntz metal y pintura a base de cobre. De manera similar, como se discutió en las aleaciones de cobre en la acuicultura, las aleaciones de cobre se han convertido en importantes materiales de compensación en la industria de la acuicultura porque son antimicrobianos y evitan el bioensuciamiento, incluso en condiciones extremas y tienen fuertes propiedades estructurales y resistentes a la corrosión en ambientes marinos.
Aplicaciones antimicrobianas
Las superficies táctiles de aleación de cobre tienen propiedades naturales que destruyen una amplia gama de microorganismos (p. Ej., E. coli O157: H7, Staphylococcus aureus resistente a la meticilina (SARM), Staphylococcus , Clostridium difficile, virus de influenza A, adenovirus y hongos). Se comprobó que unas 355 aleaciones de cobre matan a más del 99.9% de las bacterias causantes de enfermedades en solo dos horas cuando se limpian regularmente. La Agencia de Protección Ambiental de los Estados Unidos (EPA) ha aprobado los registros de estas aleaciones de cobre como "materiales antimicrobianos con beneficios para la salud pública"; esa aprobación permite a los fabricantes presentar reclamos legales sobre los beneficios para la salud pública de los productos fabricados con aleaciones registradas. Además, la EPA ha aprobado una larga lista de productos de cobre antimicrobianos fabricados con estas aleaciones, como barandas, pasamanos, mesas de cama, fregaderos, grifos, perillas de puertas, herrajes de inodoros, teclados de computadoras, equipos de gimnasios y carrito de compras mangos (para obtener una lista completa, consulte: Superficies antimicrobianas de aleación de cobre y cobre # Productos aprobados). Los pomos de las puertas de cobre son utilizados por los hospitales para reducir la transferencia de enfermedades, y la enfermedad de los legionarios es suprimida por los tubos de cobre en los sistemas de plomería. Los productos antimicrobianos de aleación de cobre se están instalando ahora en centros de salud en el Reino Unido, Irlanda, Japón, Corea, Francia, Dinamarca y Brasil y en el sistema de tránsito del metro en Santiago de Chile, donde se instalarán pasamanos de aleación de cobre y zinc en unos 30 estaciones entre 2011 y 2014.
La medicina popular
El cobre se usa comúnmente en joyería y, según algunos folclore, las pulseras de cobre alivian los síntomas de la artritis. En un ensayo para la osteoartritis y un ensayo para la artritis reumatoide no se encontraron diferencias entre el brazalete de cobre y el brazalete de control (no cobre). Ninguna evidencia muestra que el cobre pueda ser absorbido a través de la piel. Si lo fuera, podría conducir a envenenamiento de cobre.
Ropa de compresión
Recientemente, algunas prendas de compresión con cobre entrelazado se han comercializado con declaraciones de propiedades saludables similares a las de los medicamentos folclóricos. Debido a que la ropa de compresión es un tratamiento válido para algunas dolencias, la ropa puede tener ese beneficio, pero el cobre agregado puede no tener ningún beneficio más allá del efecto placebo.
Otros usos
Las fibras textiles se mezclan con cobre para crear telas protectoras antimicrobianas.
Degradación
Chromobacterium violaceum y Pseudomonas fluorescens pueden movilizar cobre sólido como un compuesto de cianuro. Los hongos micorrízicos ericoides asociados con Calluna , Erica y Vaccinium pueden crecer en suelos metalíferos que contienen cobre. El hongo ectomicorrizal Suillus luteus protege a los pinos jóvenes de la toxicidad del cobre. Una muestra del hongo Aspergillus niger se encontró creciendo a partir de la solución minera de oro y se encontró que contenía complejos cianos de metales tales como oro, plata, cobre, hierro y zinc. El hongo también juega un papel en la solubilización de sulfuros de metales pesados.
Papel biológico
Las proteínas de cobre tienen diversos papeles en el transporte biológico de electrones y el transporte de oxígeno, procesos que explotan la fácil interconversión de Cu (I) y Cu (II). El cobre es esencial en la respiración aeróbica de todos los eucariotas. En las mitocondrias, se encuentra en la citocromo c oxidasa, que es la última proteína en la fosforilación oxidativa. La citocromo c oxidasa es la proteína que se une al O 2 entre un cobre y un hierro; la proteína transfiere 8 electrones a la molécula de O 2para reducirla a dos moléculas de agua. El cobre también se encuentra en muchas superóxido dismutasas, proteínas que catalizan la descomposición de los superóxidos convirtiéndolos (por desproporción) en oxígeno y peróxido de hidrógeno:
- Cu-SOD + O 2 → Cu-SOD + O 2 (reducción de cobre; oxidación de superóxido)
- Cu-SOD + O 2 + 2H → Cu-SOD + H 2 O 2 (oxidación de cobre, reducción de superóxido)
La proteína hemocianina es el portador de oxígeno en la mayoría de los moluscos y algunos artrópodos como el cangrejo de herradura ( Limulus polyphemus ). Debido a que la hemocianina es azul, estos organismos tienen sangre azul en lugar de la sangre roja de la hemoglobina a base de hierro. Estructuralmente relacionados con la hemocianina son las lacasas y las tirosinasas. En lugar de unir de forma reversible el oxígeno, estas proteínas hidroxilan sustratos, ilustradas por su papel en la formación de lacas. El papel biológico del cobre comenzó con la aparición de oxígeno en la atmósfera terrestre. Varias proteínas de cobre, como las "proteínas azules de cobre", no interactúan directamente con los sustratos; por lo tanto, no son enzimas. Estas proteínas transmiten electrones por el proceso llamado transferencia de electrones.
Se ha encontrado un centro de cobre tetranuclear único en la reductasa de óxido nitroso.
Los compuestos químicos que se desarrollaron para el tratamiento de la enfermedad de Wilson se han investigado para su uso en la terapia contra el cáncer.
Necesidades nutricionales
El cobre es un oligoelemento esencial en plantas y animales, pero no en todos los microorganismos. El cuerpo humano contiene cobre a un nivel de aproximadamente 1.4 a 2.1 mg por kg de masa corporal. El cobre se absorbe en el intestino y luego se transporta al hígado unido a la albúmina. Después de procesar en el hígado, el cobre se distribuye a otros tejidos en una segunda fase, que implica la proteína ceruloplasmina, que lleva la mayor parte del cobre en la sangre. La ceruloplasmina también transporta el cobre que se excreta en la leche y se absorbe particularmente bien como fuente de cobre. El cobre en el cuerpo normalmente se somete a la circulación enterohepática (aproximadamente 5 mg al día, frente a aproximadamente 1 mg por día absorbido en la dieta y excretado del cuerpo), y el cuerpo puede excretar un exceso de cobre, si es necesario, a través de la bilis.
Recomendaciones dietéticas
El Instituto de Medicina de EE. UU. (IOM) actualizó los requisitos promedio estimados (EAR) y las dietas recomendadas (RDA) para el cobre en 2001. Si no hay suficiente información para establecer EAR y RDA, se utiliza una estimación designada como Ingesta adecuada (AI) en lugar. Las IA para el cobre son: 200 μg de cobre para hombres y mujeres de 0-6 meses de edad, y 220 μg de cobre para hombres y mujeres de 7-12 meses de edad. Las RDA para el cobre son: 340 μg de cobre para hombres de 1-3 años, 440 μg de cobre para hombres de 4 a 8 años, 700 μg de cobre para hombres de 9-13 años, 890 μg de cobre para hombres de 14-18 años y 900 μg de cobre para hombres de 19 años o más. Las RDA para el cobre son: 340 μg de cobre para las mujeres de 1-3 años, 440 μg de cobre para las mujeres de 4 a 8 años, 700 μg de cobre para las mujeres de 9-13 años, 890 μg de cobre para hembras de 14-18 años y 900 μg de cobre para hembras mayores de 19 años. Las RDA para el cobre son: 1,000 μg de cobre para mujeres embarazadas de 14-50 años de edad; además, 1.300 μg de cobre para hembras lactantes de 14-50 años de edad. En cuanto a la seguridad, el IOM también establece niveles de ingesta máxima tolerable (UL) de vitaminas y minerales cuando la evidencia es suficiente. En el caso del cobre, la UL se establece en 10 mg / día. En conjunto, los EAR, RDA, AI y UL se conocen como Ingestas de referencia dietéticas. el IOM también establece niveles de ingesta máxima tolerable (UL) de vitaminas y minerales cuando la evidencia es suficiente. En el caso del cobre, la UL se establece en 10 mg / día. En conjunto, los EAR, RDA, AI y UL se conocen como Ingestas de referencia dietéticas. el IOM también establece niveles de ingesta máxima tolerable (UL) de vitaminas y minerales cuando la evidencia es suficiente. En el caso del cobre, la UL se establece en 10 mg / día. En conjunto, los EAR, RDA, AI y UL se conocen como Ingestas de referencia dietéticas.
La Autoridad Europea de Seguridad Alimentaria (EFSA) se refiere al conjunto colectivo de información como valores de referencia dietéticos, con ingesta de referencia de población (PRI) en lugar de RDA, y el requisito promedio en lugar de EAR. AI y UL definieron lo mismo que en Estados Unidos. Para las mujeres y los hombres de 18 años en adelante, las IA se establecen en 1.3 y 1.6 mg / día, respectivamente. La IA para el embarazo y la lactancia es de 1.5 mg / día. Para los niños de 1 a 17 años, las IA aumentan con la edad de 0.7 a 1.3 mg / día. Estas IA son más altas que las RDA de EE. UU. La Autoridad Europea de Seguridad Alimentaria revisó la misma pregunta de seguridad y estableció su UL en 5 mg / día, que es la mitad del valor de los EE. UU.
Para fines de etiquetado de alimentos y suplementos dietéticos de los Estados Unidos, la cantidad en una porción se expresa como un porcentaje del Valor Diario (% DV). Con fines de etiquetado de cobre, el 100% del valor diario fue de 2.0 mg, pero a partir del 27 de mayo de 2016 fue revisado a 0.9 mg para que esté de acuerdo con la RDA. Se proporciona una tabla de los valores diarios de adultos antiguos y nuevos en la Ingesta diaria de referencia. La fecha límite original para estar en cumplimiento fue el 28 de julio de 2018, pero el 29 de septiembre de 2017 la FDA publicó una regla propuesta que extendía el plazo hasta el 1 de enero de 2020 para grandes empresas y el 1 de enero de 2021 para pequeñas empresas.
Deficiencia
Debido a su papel en facilitar la absorción de hierro, la deficiencia de cobre puede producir síntomas similares a la anemia, neutropenia, anomalías óseas, hipopigmentación, deterioro del crecimiento, aumento de la incidencia de infecciones, osteoporosis, hipertiroidismo y anomalías en el metabolismo de la glucosa y el colesterol. Por el contrario, la enfermedad de Wilson causa una acumulación de cobre en los tejidos del cuerpo.
La deficiencia severa se puede encontrar probando niveles bajos de cobre en plasma o suero, baja cantidad de ceruloplasmina y bajos niveles de superóxido dismutasa en los glóbulos rojos; estos no son sensibles al estado marginal del cobre. La "actividad citocromo c oxidasa de leucocitos y plaquetas" se ha establecido como otro factor en la deficiencia, pero los resultados no se han confirmado por replicación.
Toxicidad
| Diamante de fuego NFPA 704 |
|---|
 0 2 0 |
Diamante de fuego para metal de cobre
Cantidades de gramos de varias sales de cobre se han tomado en intentos de suicidio y han producido toxicidad aguda de cobre en humanos, posiblemente debido al ciclo redox y la generación de especies reactivas de oxígeno que dañan el ADN. Las cantidades correspondientes de sales de cobre (30 mg / kg) son tóxicas en animales. Se ha informado que un valor dietético mínimo para un crecimiento saludable en conejos es de al menos 3 ppm en la dieta. Sin embargo, concentraciones más altas de cobre (100 ppm, 200 ppm o 500 ppm) en la dieta de los conejos pueden influir favorablemente en la eficiencia de la conversión alimenticia, las tasas de crecimiento y los porcentajes de vísceras en canal.
La toxicidad crónica del cobre no ocurre normalmente en humanos debido a los sistemas de transporte que regulan la absorción y la excreción. Las mutaciones autosómicas recesivas en proteínas de transporte de cobre pueden desactivar estos sistemas, lo que lleva a la enfermedad de Wilson con la acumulación de cobre y la cirrosis del hígado en personas que han heredado dos genes defectuosos.
Los niveles elevados de cobre también se han relacionado con el empeoramiento de los síntomas de la enfermedad de Alzheimer.
Exposición humana
En los EE. UU., La Administración de Seguridad y Salud Ocupacional (OSHA) ha designado un límite de exposición permisible (PEL) para polvo y humos de cobre en el lugar de trabajo como un promedio ponderado de tiempo (TWA) de 1 mg / m. El Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH) ha establecido un límite de exposición recomendado (REL) de 1 mg / m, promedio ponderado en el tiempo. El valor IDLH (inmediatamente peligroso para la vida y la salud) es de 100 mg / m.
El cobre es un componente del humo del tabaco. La planta de tabaco absorbe y acumula fácilmente metales pesados, como el cobre del suelo circundante en sus hojas. Estos se absorben fácilmente en el cuerpo del usuario después de la inhalación de humo. Las implicaciones de salud no son claras.
Obtenido de: https://en.wikipedia.org/wiki/Copper