Reacción ácido-base
Definición
Una reacción ácido-base es una reacción química que se produce entre un ácido y una base, que se puede utilizar para determinar el pH. Varios marcos teóricos proporcionan concepciones alternativas de los mecanismos de reacción y su aplicación para resolver problemas relacionados; a estas se les llama teorías ácido-base, por ejemplo, la teoría ácido-base de Brønsted-Lowry.Su importancia se vuelve aparente al analizar reacciones ácido-base para especies gaseosas o líquidas, o cuando el carácter ácido o base puede ser algo menos aparente. El primero de estos conceptos fue proporcionado por el químico francés Antoine Lavoisier, hacia 1776.
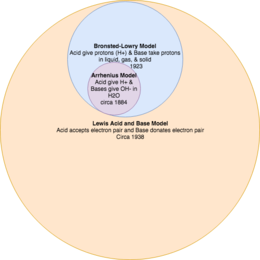
Es importante pensar en los modelos de reacción ácido-base como teorías que se complementan entre sí. Por ejemplo, el modelo actual de Lewis tiene la definición más amplia de lo que son un ácido y una base, con la teoría de Bronsted-Lowry como un subconjunto de lo que son los ácidos y las bases, y la teoría de Arrhenius es la más restrictiva.
Definiciones ácido-base
Desarrollo histórico
La teoría del oxígeno de Lavoisier de los ácidos
El primer concepto científico de ácidos y bases fue proporcionado por Lavoisier alrededor de 1776. Dado que el conocimiento de Lavoisier de ácidos fuertes se limitaba principalmente a oxoácidos, como HNO 3 (ácido nítrico) y H 2 SO 4 (ácido sulfúrico), que tienden a contener átomos centrales en altos estados de oxidación rodeados de oxígeno, y dado que no estaba al tanto de la verdadera composición de los ácidos halohídricos (HF, HCl, HBr y HI), definió los ácidos en términos de su contenido de oxígeno , que de hecho llamó de las palabras griegas que significan "ácido-formador" (del griego οξυς ( oxys ) que significa "ácido" o "agudo" y γεινομαι ( geinomai)) que significa "engendrar"). La definición de Lavoisier se mantuvo durante más de 30 años, hasta el artículo de 1810 y las posteriores conferencias de Sir Humphry Davy en las que demostró la falta de oxígeno en H 2 S , H 2 Te y los ácidos hidrohálicos. Sin embargo, Davy no pudo desarrollar una nueva teoría, concluyendo que "la acidez no depende de ninguna sustancia elemental particular, sino de una disposición peculiar de varias sustancias". Una modificación notable de la teoría del oxígeno fue proporcionada por Berzelius, quien afirmó que los ácidos son óxidos de los no metales, mientras que las bases son óxidos de los metales.
La teoría del hidrógeno de Liebig de los ácidos
En 1838, Justus von Liebig propuso que un ácido es una sustancia que contiene hidrógeno en la cual el hidrógeno podría ser reemplazado por un metal. Esta redefinición se basó en su extenso trabajo sobre la composición química de los ácidos orgánicos, terminando el cambio doctrinal de los ácidos a base de oxígeno a los ácidos a base de hidrógeno iniciados por Davy. La definición de Liebig, aunque completamente empírica, se mantuvo en uso durante casi 50 años hasta la adopción de la definición de Arrhenius.
Definición de Arrhenius
La primera definición moderna de ácidos y bases en términos moleculares fue ideada por Svante Arrhenius. Una teoría del hidrógeno de los ácidos, se siguió de su trabajo de 1884 con Friedrich Wilhelm Ostwald al establecer la presencia de iones en solución acuosa y llevó a Arrhenius a recibir el Premio Nobel de Química en 1903.
Según lo definido por Arrhenius:
- un ácido de Arrhenius es una sustancia que se disocia en agua para formar iones de hidrógeno (H); es decir, un ácido aumenta la concentración de iones H en una solución acuosa.
Esto causa la protonación del agua o la creación del ion hidronio (H 3 O). Por lo tanto, en los tiempos modernos, el símbolo H se interpreta como una abreviación de H 3 O, porque ahora se sabe que un protón no existe como una especie libre en solución acuosa.
- una base de Arrhenius es una sustancia que se disocia en agua para formar iones hidróxido (OH); es decir, una base aumenta la concentración de iones OH en una solución acuosa.
Las definiciones de Arrhenius de acidez y alcalinidad están restringidas a soluciones acuosas, y se refieren a la concentración de los iones solventes. Según esta definición, el H 2 SO 4 puro y el HCl disueltos en tolueno no son ácidos, y el NaOH fundido y las soluciones de amida cálcica en amoniaco líquido no son alcalinas. Esto condujo al desarrollo de la teoría de Bronsted-Lowry y la posterior teoría de Lewis para dar cuenta de estas excepciones no acuosas.
En general, para calificar como ácido de Arrhenius, en la introducción al agua, el producto químico debe causar, directamente o de otro modo:
- un aumento en la concentración acuosa de hidronio, o
- una disminución en la concentración de hidróxido acuoso.
Por el contrario, para calificar como una base de Arrhenius, al introducirse en el agua, la sustancia química debe causar, directamente o de otro modo:
- una disminución en la concentración acuosa de hidronio, o
- un aumento en la concentración de hidróxido acuoso.
La reacción de un ácido con una base se llama reacción de neutralización. Los productos de esta reacción son una sal y agua.
- ácido + base → sal + agua
En esta representación tradicional, se formula una reacción de neutralización ácido-base como una reacción de doble sustitución. Por ejemplo, la reacción de ácido clorhídrico, HCl, con soluciones de hidróxido de sodio, NaOH, produce una solución de cloruro de sodio, NaCl y algunas moléculas de agua adicionales.
- HCl (aq) + NaOH (aq) → NaCl (aq) + H 2 O
El modificador (aq) en esta ecuación fue implícito por Arrhenius, en lugar de ser incluido explícitamente. Indica que las sustancias están disueltas en agua. Aunque las tres sustancias, HCl, NaOH y NaCl son capaces de existir como compuestos puros, en soluciones acuosas se disocian completamente en los iones acuosos H, Cl, Na y OH.
Definición de Brønsted-Lowry
  | |
| Johannes Nicolaus Brønsted y Thomas Martin Lowry |
La definición de Brønsted-Lowry, formulada en 1923, independientemente por Johannes Nicolaus Brønsted en Dinamarca y Martin Lowry en Inglaterra, se basa en la idea de protonación de bases mediante la desprotonación de ácidos, es decir, la capacidad de los ácidos de "donar" "iones de hidrógeno (H) -de lo contrario, conocidos como protones- a bases, que los" aceptan ".
Una reacción ácido-base es, por lo tanto, la eliminación de un ion de hidrógeno del ácido y su adición a la base. La eliminación de un ion de hidrógeno de un ácido produce su base conjugada , que es el ácido con un ion de hidrógeno eliminado. La recepción de un protón por una base produce su ácido conjugado , que es la base con un ion de hidrógeno agregado.
A diferencia de las definiciones anteriores, la definición de Brønsted-Lowry no se refiere a la formación de sal y disolvente, sino a la formación de ácidos conjugados y bases conjugadas, producido por la transferencia de un protón del ácido a la base. En este enfoque, los ácidos y bases son fundamentalmente diferentes en el comportamiento de las sales, que se consideran electrolitos, sujetos a las teorías de Debye, Onsager y otros. Un ácido y una base reaccionan para no producir una sal y un solvente, sino para formar un nuevo ácido y una nueva base. El concepto de neutralización está ausente. El comportamiento de la base ácida Brønsted-Lowry es formalmente independiente de cualquier solvente, lo que lo hace más abarcador que el modelo de Arrhenius. El cálculo del pH bajo el modelo de Arrhenius dependía de los álcalis (bases) que se disolvían en agua (solución acuosa). El modelo de Brønsted-Lowry amplió lo que se pudo probar con pH usando soluciones insolubles y solubles (gas, líquido, sólido).
La fórmula general para las reacciones ácido-base de acuerdo con la definición de Brønsted-Lowry es:
- HA + B → BH + A
donde HA representa el ácido, B representa la base, BH representa el ácido conjugado de B y A representa la base conjugada de HA.
Por ejemplo, un modelo de Brønsted-Lowry para la disociación del ácido clorhídrico (HCl) en solución acuosa sería el siguiente:
- HCl + H 2 O ⇌ H 3 O + Cl
La eliminación de H del HCl produce el ion cloruro, Cl, la base conjugada del ácido. La adición de H al H 2 O (que actúa como una base) forma el ion hidronio, H 3 O, el ácido conjugado de la base.
El agua es anfótera, es decir, puede actuar como un ácido y una base. El modelo de Brønsted-Lowry explica esto, mostrando la disociación del agua en bajas concentraciones de iones de hidronio e hidróxido:
- H 2 O + H 2 O ⇌ H 3 O + OH
Esta ecuación se demuestra en la imagen a continuación:

Aquí, una molécula de agua actúa como un ácido, donando una H y formando la base conjugada, OH, y una segunda molécula de agua actúa como una base, aceptando el ion H y formando el ácido conjugado, H 3 O.
Como ejemplo de agua que actúa como un ácido, considere una solución acuosa de piridina, C 5 H 5N.
- C 5 H 5 N + H 2 O ⇌ [C 5 H 5 NH] + OH
En este ejemplo, una molécula de agua se divide en un ion de hidrógeno, que se dona a una molécula de piridina y un ion hidróxido.
En el modelo de Brønsted-Lowry, el solvente no necesariamente tiene que ser agua requerida por el modelo Arrhenius Acid-Base. Por ejemplo, considere lo que sucede cuando el ácido acético, CH 3COOH, se disuelve en amoníaco líquido.
- CH3 COOH + NH3 ⇌ NH+ 4 + CH3 COO-
Se elimina un ion H del ácido acético, formando su base conjugada, el ion acetato, CH 3 COO. La adición de un ion H a una molécula de amoníaco del solvente crea su ácido conjugado, el ion amonio, NH +
4 .
4 .
El modelo de Brønsted-Lowry denomina ácidos que contienen hidrógeno (como el HCl). Por lo tanto, algunas sustancias, que muchos químicos consideran ácidos, como SO 3 o BCl 3 , se excluyen de esta clasificación debido a la falta de hidrógeno. Gilbert N. Lewis escribió en 1938, "restringir el grupo de ácidos a aquellas sustancias que contienen hidrógeno interfiere tan seriamente con la comprensión sistemática de la química como lo haría la restricción del término agente oxidante a sustancias que contienen oxígeno". Además, KOH y KNH 2 no se consideran bases Brønsted, sino sales que contienen las bases OH y NH -
2 .
2 .
Definición de Lewis
El requerimiento de hidrógeno de Arrhenius y Brønsted-Lowry fue eliminado por la definición de Lewis de reacciones ácido-base, ideado por Gilbert N. Lewis en 1923, en el mismo año que Brønsted-Lowry, pero no fue elaborado por él hasta 1938. En cambio de definir reacciones ácido-base en términos de protones u otras sustancias enlazadas, la definición de Lewis define una base (denominada base de Lewis ) como un compuesto que puede donar un par de electrones , y un ácido (un ácido de Lewis ) para ser un compuesto que puede recibir este par de electrones.
Por ejemplo, trifluoruro de boro, BF 3 es un ácido típico Lewis. Puede aceptar un par de electrones ya que tiene una vacante en su octeto. El ion fluoruro tiene un octeto completo y puede donar un par de electrones. Así
- BF 3 + F → BF - 4
es un ácido de Lewis típico, reacción de base de Lewis. Todos los compuestos de elementos del grupo 13 con una fórmula AX 3 pueden comportarse como ácidos de Lewis. De forma similar, los compuestos de los elementos del grupo 15 con una fórmula DY 3 , tales como aminas, NR 3 y fosfinas, PR 3 , pueden comportarse como bases de Lewis. Los aductos entre ellos tienen la fórmula X 3 A ← DY 3 con un enlace covalente dativo, que se muestra simbólicamente como ←, entre los átomos A (aceptor) y D (donante). Los compuestos del grupo 16 con una fórmula DX 2 también pueden actuar como bases de Lewis; de esta manera, un compuesto como un éter, R 2 O o un tioéter, R 2S, puede actuar como una base de Lewis. La definición de Lewis no se limita a estos ejemplos. Por ejemplo, el monóxido de carbono actúa como una base de Lewis cuando forma un aducto con trifluoruro de boro, de fórmula F 3 B ← CO
Los aductos que implican iones metálicos se denominan compuestos de coordinación; cada ligando dona un par de electrones al ion metálico. La reacción
- [Ag (H 2 O) 4 ] + 2NH 3 → [Ag (NH 3 ) 2 ] + 4H 2 O
puede verse como una reacción ácido-base en la que una base más fuerte (amoníaco) reemplaza a una más débil (agua)
Las definiciones de Lewis y Brønsted-Lowry son consistentes entre sí ya que la reacción
- H + OH ⇌ H 2 O
es una reacción ácido-base en ambas teorías.
Definición del sistema solvente
Una de las limitaciones de la definición de Arrhenius es su dependencia de las soluciones de agua. Edward Curtis Franklin estudió las reacciones ácido-base en el amoníaco líquido en 1905 y señaló las similitudes con la teoría de Arrhenius basada en el agua. Albert FO Germann, trabajando con fosgeno líquido, COCl
2 , formuló la teoría basada en solventes en 1925, generalizando así la definición de Arrhenius para cubrir los solventes apróticos.
2 , formuló la teoría basada en solventes en 1925, generalizando así la definición de Arrhenius para cubrir los solventes apróticos.
Germann señaló que en muchas soluciones, hay iones en equilibrio con las moléculas de solvente neutro:
- solvonium : nombre genérico para un ion positivo.
- solvato : un nombre genérico para un ion negativo.
Por ejemplo, el agua y el amoníaco experimentan tal disociación en hidronio e hidróxido, y amonio y amida, respectivamente:
- 2 H2 O ⇌ H3 O+ + OH -
- 2 NH3 ⇌ NH+ 4 + NH- 2
Algunos sistemas apróticos también sufren dicha disociación, como el tetróxido de dinitrógeno en nitrosonio y nitrato, el tricloruro de antimonio en dicloroantimonio y tetracloroantimonato, y el fosgeno en clorocarboxonio y cloruro:
- norte2 O4 ⇌ NO+ + NO - 3
- 2 SbCl3 ⇌ SbCl+ 2 + SbCl- 4
- COCl2 ⇌ COCl+ + Cl -
Un soluto que causa un aumento en la concentración de iones de solvonio y una disminución en la concentración de iones de solvato se define como un ácido . Un soluto que causa un aumento en la concentración de iones de solvato y una disminución en la concentración de iones de solvonio se define como una base .
Por lo tanto, en amoníaco líquido, KNH
2 (suministro de NH-
2 ) es una base sólida, y NH
4 NO
3 (suministro de NH+
4 ) es un ácido fuerte. En dióxido de azufre líquido (SO
2 ), compuestos de tionilo (que suministran SO2+
) se comportan como ácidos y los sulfitos (que suministran SO 2
3 ) se comportan como bases.
2 (suministro de NH-
2 ) es una base sólida, y NH
4 NO
3 (suministro de NH+
4 ) es un ácido fuerte. En dióxido de azufre líquido (SO
2 ), compuestos de tionilo (que suministran SO2+
) se comportan como ácidos y los sulfitos (que suministran SO 2
3 ) se comportan como bases.
Las reacciones ácido-base no acuosas en amoníaco líquido son similares a las reacciones en agua:
- 2 NaNH2(base) + Zn ( NH2 )2(amida anfifílica) → Na2 [ Zn ( NH2 )4
- 2 NH4 I(ácido) + Zn ( NH2 )2(amida anfífila) → [Zn (NH2 )4 )] I2
El ácido nítrico puede ser una base en el ácido sulfúrico líquido:
- HNO3(base) + 2 H2 SO4 → NO+ 2 + H3 O+ + 2 HSO - 4
La fuerza única de esta definición se muestra al describir las reacciones en solventes apróticos; por ejemplo, en líquido N
2 O
4 :
2 O
4 :
- AgNO3(base) + NOCl(ácido) → N2 O4(solvente) + AgCl(sal)
Debido a que la definición del sistema de solvente depende tanto del soluto como del solvente mismo, un soluto particular puede ser un ácido o una base dependiendo de la elección del solvente: HClO
4 es un ácido fuerte en agua, un ácido débil en ácido acético y una base débil en ácido fluorosulfónico; esta característica de la teoría se ha visto como una fortaleza y una debilidad, porque algunas sustancias (como SO
3 y NH
3 ) han sido vistos como ácidos o básicos por derecho propio. Por otro lado, la teoría del sistema solvente ha sido criticada por ser demasiado general para ser útil. Además, se ha pensado que hay algo intrínsecamente ácido sobre los compuestos de hidrógeno, una propiedad no compartida por las sales de solvonio no hidrogénicas.
4 es un ácido fuerte en agua, un ácido débil en ácido acético y una base débil en ácido fluorosulfónico; esta característica de la teoría se ha visto como una fortaleza y una debilidad, porque algunas sustancias (como SO
3 y NH
3 ) han sido vistos como ácidos o básicos por derecho propio. Por otro lado, la teoría del sistema solvente ha sido criticada por ser demasiado general para ser útil. Además, se ha pensado que hay algo intrínsecamente ácido sobre los compuestos de hidrógeno, una propiedad no compartida por las sales de solvonio no hidrogénicas.
Definición de Lux-Flood
Esta teoría ácido-base fue una reactivación de la teoría del oxígeno de ácidos y bases, propuesta por el químico alemán Hermann Lux en 1939, mejorada por Håkon Flood alrededor de 1947 y todavía se usa en la geoquímica moderna y la electroquímica de sales fundidas. Esta definición describe un ácido como un ion de óxido ( O 2-
) aceptor y una base como donador de iones de óxido. Por ejemplo:
) aceptor y una base como donador de iones de óxido. Por ejemplo:
- MgO(base) + CO2(ácido) → MgCO3
- CaO(base) + SiO2(ácido) → CaSiO3
- NO - 3(base) + S2 O2- 7(ácido) → NO+ 2 + 2 SO2- 4
Esta teoría también es útil en la sistematización de las reacciones de compuestos de gases nobles, especialmente los óxidos de xenón, fluoruros y oxofluoruros.
La definición de Usanovich
Mikhail Usanovich desarrolló una teoría general que no restringe la acidez a los compuestos que contienen hidrógeno, pero su enfoque, publicado en 1938, fue incluso más general que la teoría de Lewis. La teoría de Usanovich se puede resumir como la definición de un ácido como cualquier cosa que acepte especies negativas o done las positivas, y una base como el reverso. Esto definió el concepto de redox (oxidación-reducción) como un caso especial de reacciones ácido-base
Algunos ejemplos de reacciones de ácido base de Usanovich incluyen:
- N / A2 O(base) + SO3(ácido) → 2 Na+ + SO 2- 4 (especie intercambiada: O 2- anión)
- 3 ( NH4 )2 S(base) + Sb2 S5(ácido) → 6 NH+ 4 + 2 SbS3- 4 (especies intercambiadas: 3 S2- aniones)
- 2Na(base) + Cl2(ácido) → 2Na+ + 2 Cl - (especie intercambiada: 2 electrones)
Racionalizando la fuerza de las interacciones Lewis ácido-base
Teoría de HSAB
En 1963, Ralph Person propuso un concepto cualitativo conocido como el principio de ácidos y bases duros y blandos. luego se hizo cuantitativo con la ayuda de Robert Parr en 1984. "Difícil" se aplica a especies que son pequeñas, tienen estados de carga elevados y son débilmente polarizables. 'Suave' se aplica a especies que son grandes, tienen estados de carga bajos y son fuertemente polarizables. Los ácidos y las bases interactúan, y las interacciones más estables son duras-duras y suaves-suaves. Esta teoría ha encontrado uso en la química orgánica e inorgánica.
Modelo ECW
El modelo ECW es modelo cuantitativo que describe y predice la fuerza de las interacciones de base ácido de Lewis, -Δ H . El modelo asignó los parámetros E y C a muchos ácidos y bases de Lewis. Cada ácido se caracteriza por un E A y una C A . Cada base se caracteriza asimismo por su propio E B y C B . Los parámetros E y C se refieren, respectivamente, a las contribuciones electrostáticas y covalentes a la fuerza de los enlaces que formarán el ácido y la base. La ecuación es
- -Δ H = E A E B + C A C B + W
El término W representa una contribución de energía constante para la reacción ácido-base tal como la escisión de una base o ácido dimérico. La ecuación predice la reversión de los ácidos y las resistencias de la base. Las presentaciones gráficas de la ecuación muestran que no existe un orden único de las resistencias de la base de Lewis o de los ácidos de Lewis.
Equilibrio ácido-base
La reacción de un ácido fuerte con una base fuerte es esencialmente una reacción cuantitativa. Por ejemplo,
- HCl (aq) + Na (OH) (aq) → H 2 O + NaCl (aq)
En esta reacción, tanto los iones sodio y cloruro son espectadores como la reacción de neutralización,
- H + OH → H 2 O
no los involucra. Con bases débiles, la adición de ácido no es cuantitativa porque una solución de una base débil es una solución tampón. Una solución de un ácido débil también es una solución tampón. Cuando un ácido débil reacciona con una base débil, se produce una mezcla de equilibrio. Por ejemplo, adenina, escrito como AH puede reaccionar con un ion hidrógeno fosfato, HPO 2-
4 .
4 .
- AH + HPO 2- 4 ⇌ A + H2 PO- 4
La constante de equilibrio para esta reacción puede derivarse de las constantes de disociación ácida de la adenina y del ion dihidrógeno fosfato.
- [A] [H] = K a1 [AH]
- [ HPO 2- 4 ] [H] = K a2 [ H2 PO- 4 ]
La notación [X] significa "concentración de X". Cuando estas dos ecuaciones se combinan eliminando la concentración de iones de hidrógeno, se obtiene una expresión para la constante de equilibrio, K.
- [A] [ H2 PO- 4 ] = K[AH] [HPO2-
Reacción ácida-alcalina
Una reacción ácido-álcali es un caso especial de una reacción ácido-base, donde la base utilizada también es un álcali. Cuando un ácido reacciona con una sal alcalina (un hidróxido de metal), el producto es una sal metálica y agua. Las reacciones ácido-alcalino también son reacciones de neutralización.En general, las reacciones ácido-alcalinas se pueden simplificar a- OH -(aq) + H +(aq) → H2 O
al omitir los iones espectadores.Los ácidos son en general sustancias puras que contienen cationes de hidrógeno ( H +
) o hacer que se produzcan en soluciones. Ácido clorhídrico ( HCl ) y ácido sulfúrico ( H
2 SO
4 ) son ejemplos comunes. En el agua, estos se separan en iones:- HCl → H +(aq) + Cl -(aq)
- H2 SO4 → H+(aq) + HSO - 4 (aq)
El álcali se rompe en agua, produciendo iones hidróxido disueltos:- NaOH → Na +(aq) + OH -(aq)