Oro
Definición
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Apariencia | amarillo metálico | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atómico estándar ( A r, estándar ) | 196.966 569 (5) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oro en la tabla periódica | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número atómico ( Z ) | 79 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo | grupo 11 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Período | período 6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoría de elemento | metal de transición | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bloquear | d-block | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electronica | [Xe] 4f 5d 6s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Electrons per shell | 2, 8, 18, 32, 18, 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 1337.33 K (1064.18 °C, 1947.52 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 3243 K (2970 °C, 5378 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 19.30 g/cm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 17.31 g/cm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 12.55 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 342 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 25.418 J/(mol•K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | 5, 3, 2, 1, −1, −2, −3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 2.54 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 144 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 136±6 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio Van der Waals | 166 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelánea | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | centrado en la cara cúbico (fcc) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad de la varilla delgada de sonido | 2030 m / s (a rt ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Expansión térmica | 14.2 μm / (m • K) (a 25 ° C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 318 W / (m • K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistividad electrica | 22.14 nΩ • m (a 20 ° C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | diamagnético | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Susceptibilidad magnética | -28.0 • 10 cm / mol (a 296 K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistencia a la tracción | 120 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| El módulo de Young | 79 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de corte | 27 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de volumen | 180 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relación de Poisson | 0.4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 2.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Vickers | 188-216 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 188-245 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número CAS | 7440-57-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombrando | de latín aurum , que significa oro | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | En Medio Oriente(antes del 6000 aC) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Principales isótopos de oro | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El oro es un elemento químico con el símbolo Au (del latín: aurum ) y el número atómico 79, por lo que es uno de los numbelementos más altos que se producen naturalmente. En su forma más pura, es un metal brillante, ligeramente rojizo, denso, suave, maleable y dúctil. Químicamente, el oro es un metal de transición y un elemento del grupo 11. Es uno de los elementos químicos menos reactivos y es sólido en condiciones estándar. El oro a menudo ocurre en forma elemental (nativa) libre, como nuggets o granos, en rocas, en vetas y en depósitos aluviales. Ocurre en una serie de soluciones sólidas con el elemento nativo plateado (como electrum) y también, naturalmente, aleado con cobre y paladio. Con menos frecuencia, ocurre en minerales como compuestos de oro, a menudo con telurio (telururos de oro).
El oro es resistente a la mayoría de los ácidos, aunque se disuelve en agua regia, una mezcla de ácido nítrico y ácido clorhídrico, que forma un anión tetracloroaurato soluble. El oro es insoluble en el ácido nítrico, que disuelve la plata y los metales básicos, una propiedad que se ha usado durante mucho tiempo para refinar el oro y para confirmar la presencia de oro en los objetos metálicos, dando lugar al término prueba de ácido . El oro también se disuelve en soluciones alcalinas de cianuro, que se utilizan en la minería y la electrodeposición. El oro se disuelve en mercurio, formando aleaciones de amalgama, pero esta no es una reacción química.
A relatively rare element, gold is a precious metal that has been used for coinage, jewelry, and other arts throughout recorded history. In the past, a gold standard was often implemented as a monetary policy, but gold coins ceased to be minted as a circulating currency in the 1930s, and the world gold standard was abandoned for a fiat currency system after 1971.
A total of 186,700 tonnes of gold exists above ground, as of 2015. The world consumption of new gold produced is about 50% in jewelry, 40% in investments, and 10% in industry. Gold's high malleability, ductility, resistance to corrosion and most other chemical reactions, and conductivity of electricity have led to its continued use in corrosion resistant electrical connectors in all types of computerized devices (its chief industrial use). Gold is also used in infrared shielding, colored-glass production, gold leafing, and tooth restoration. Certain gold salts are still used as anti-inflammatories in medicine. As of 2016, the world's largest gold producer by far was China with 450 tonnes per year.
Characteristics
El oro es el más maleable de todos los metales; un solo gramo se puede batir en una hoja de 1 metro cuadrado, y una onza de avoirdupois en 300 pies cuadrados. La hoja de oro se puede batir lo suficiente como para ser semitransparente. La luz transmitida aparece azul verdosa porque el oro refleja fuertemente el amarillo y el rojo. Estas láminas semitransparentes también reflejan fuertemente la luz infrarroja, haciéndolas útiles como escudos infrarrojos (calor radiante) en viseras de trajes resistentes al calor, y en viseras solares para trajes espaciales. El oro es un buen conductor de calor y electricidad.
El oro tiene una densidad de 19.3 g / cm, casi idéntica a la del tungsteno a 19.25 g / cm; como tal, el tungsteno se ha utilizado en la falsificación de barras de oro, como enchapar una barra de tungsteno con oro o tomar una barra de oro existente, perforar agujeros y reemplazar el oro eliminado con varillas de tungsteno. En comparación, la densidad del plomo es 11.34 g / cm, y la del elemento más denso, osmio, es 22.588 ± 0.015 g / cm .
Color
Mientras que la mayoría de los metales son grises o plateados, el oro es ligeramente amarillo rojizo. Este color está determinado por la frecuencia de las oscilaciones del plasma entre los electrones de valencia del metal, en el rango ultravioleta para la mayoría de los metales, pero en el rango visible para el oro debido a los efectos relativistas que afectan a los orbitales alrededor de los átomos de oro. Efectos similares imparten un tono dorado al cesio metálico.
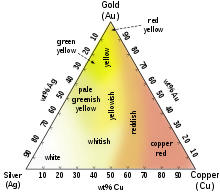
Las aleaciones de oro de colores comunes incluyen el distintivo oro rosa de dieciocho quilates creado por la adición de cobre. Las aleaciones que contienen paladio o níquel también son importantes en las joyas comerciales, ya que producen aleaciones de oro blanco. La aleación de oro y cobre de catorce quilates es de un color casi idéntico a la de ciertas aleaciones de bronce, y ambas se pueden usar para producir la policía y otras insignias. Las aleaciones de oro blanco se pueden hacer con paladio o níquel. Las aleaciones de oro de catorce y dieciocho quilates con plata solo tienen un color amarillo verdoso y se las conoce como oro verde. El oro azul se puede hacer mediante la aleación con hierro, y el oro púrpura se puede hacer mediante la aleación con aluminio. Con menos frecuencia, la adición de manganeso, aluminio, indio y otros elementos puede producir colores de oro más inusuales para diversas aplicaciones.
El oro coloidal, utilizado por los microscopistas electrónicos, es rojo si las partículas son pequeñas; las partículas más grandes de oro coloidal son azules.
Isótopos
El oro tiene un solo isótopo estable, 197
Au , que también es su único isótopo de origen natural, por lo que el oro es un elemento tanto mononuclídico como monoisotópico. Treinta y seis radioisótopos se han sintetizado en una masa atómica de 169 a 205. El más estable de estos es 195
Au con una vida media de 186.1 días. El menos estable es 171
Au , que se descompone por emisión de protones con una vida media de 30 μs. La mayoría de los radioisótopos de oro con masas atómicas por debajo de 197 se descomponen por alguna combinación de emisión de protones, decaimiento α y decaimiento β. Las excepciones son 195
Au , que decae por captura de electrones, y 196
Au , que se descompone más a menudo por la captura de electrones (93%) con un camino de desintegración β menor (7%). Todos los radioisótopos de oro con masas atómicas por encima de 197 se descomponen por desintegración β.
Au , que también es su único isótopo de origen natural, por lo que el oro es un elemento tanto mononuclídico como monoisotópico. Treinta y seis radioisótopos se han sintetizado en una masa atómica de 169 a 205. El más estable de estos es 195
Au con una vida media de 186.1 días. El menos estable es 171
Au , que se descompone por emisión de protones con una vida media de 30 μs. La mayoría de los radioisótopos de oro con masas atómicas por debajo de 197 se descomponen por alguna combinación de emisión de protones, decaimiento α y decaimiento β. Las excepciones son 195
Au , que decae por captura de electrones, y 196
Au , que se descompone más a menudo por la captura de electrones (93%) con un camino de desintegración β menor (7%). Todos los radioisótopos de oro con masas atómicas por encima de 197 se descomponen por desintegración β.
También se han caracterizado al menos 32 isómeros nucleares, que varían en masa atómica de 170 a 200. Dentro de ese rango, solo 178
Au , 180
Au , 181
Au , 182
Au y 188
Au no tiene isómeros. El isómero más estable del oro es 198m2
Au con una vida media de 2,27 días. El isómero menos estable del oro es 177m2
Au con una vida media de solo 7 ns. 184m1
Au tiene tres rutas de decaimiento: decaimiento β, transición isomérica y decaimiento alfa. Ningún otro isómero o isótopo de oro tiene tres rutas de desintegración.
Au , 180
Au , 181
Au , 182
Au y 188
Au no tiene isómeros. El isómero más estable del oro es 198m2
Au con una vida media de 2,27 días. El isómero menos estable del oro es 177m2
Au con una vida media de solo 7 ns. 184m1
Au tiene tres rutas de decaimiento: decaimiento β, transición isomérica y decaimiento alfa. Ningún otro isómero o isótopo de oro tiene tres rutas de desintegración.
Síntesis
La producción de oro a partir de un elemento más común, como el plomo, ha sido durante mucho tiempo un tema de investigación humana, y la disciplina antigua y medieval de la alquimia a menudo se centraba en ella; sin embargo, la transmutación de los elementos químicos no fue posible hasta la comprensión de la física nuclear en el siglo XX. La primera síntesis de oro fue realizada por el físico japonés Hantaro Nagaoka, quien sintetizó oro a partir de mercurio en 1924 mediante bombardeo de neutrones. Un equipo estadounidense, trabajando sin conocimiento del estudio previo de Nagaoka, realizó el mismo experimento en 1941, logrando el mismo resultado y mostrando que los isótopos del oro producidos por él eran todos radiactivos.
Actualmente, el oro se puede fabricar en un reactor nuclear mediante irradiación de platino o mercurio.
Solo el isótopo de mercurio Hg, que se produce con una frecuencia del 0,15% en mercurio natural, se puede convertir en oro mediante captura de neutrones, y después de la captura de electrones se descompone en Au con neutrones lentos. Otros isótopos de mercurio se convierten cuando se irradian con neutrones lentos entre sí, o forman isótopos de mercurio que se desintegran beta en talio.
Usando neutrones rápidos, el isótopo de mercurio Hg, que compone el 9,97% del mercurio natural, se puede convertir dividiendo un neutrón y convirtiéndose en Hg, que luego se desintegra en oro estable. Esta reacción, sin embargo, posee una sección transversal de activación más pequeña y es factible solo con reactores no moderados.
También es posible expulsar varios neutrones con muy alta energía en los otros isótopos de mercurio para formar Hg. Sin embargo, tales neutrones de alta energía solo pueden ser producidos por aceleradores de partículas.
Química
Aunque el oro es el más noble de los metales nobles, todavía forma muchos compuestos diversos. El estado de oxidación del oro en sus compuestos varía de -1 a +5, pero Au (I) y Au (III) dominan su química. Au (I), denominado ión aurous, es el estado de oxidación más común con ligandos blandos tales como tioéteres, tiolatos y fosfinas terciarias. Los compuestos de Au (I) son típicamente lineales. Un buen ejemplo es Au (CN)
2 , que es la forma soluble de oro encontrada en la minería. Los haluros binarios de oro, como el AuCl, forman cadenas poligonales en zigzag, una vez más con coordinación lineal en Au. La mayoría de los medicamentos basados en oro son derivados de Au (I).
2 , que es la forma soluble de oro encontrada en la minería. Los haluros binarios de oro, como el AuCl, forman cadenas poligonales en zigzag, una vez más con coordinación lineal en Au. La mayoría de los medicamentos basados en oro son derivados de Au (I).
Au (III) (áurico) es un estado de oxidación común, y está ilustrado por el cloruro de oro (III), Au 2 Cl 6 . Los centros del átomo de oro en complejos Au (III), como otros compuestos D, son típicamente planar cuadrados, con enlaces químicos que tienen carácter tanto covalente como iónico.
El oro no reacciona con el oxígeno a ninguna temperatura y, hasta 100 ° C, es resistente al ataque del ozono.
Algunos halógenos libres reaccionan con el oro. El oro es fuertemente atacado por el flúor a un calor rojo opaco para formar fluoruro de oro (III). El oro en polvo reacciona con cloro a 180 ° C para formar AuCl
3 . El oro reacciona con el bromo a 140 ° C para formar el bromuro de oro (III), pero reacciona muy lentamente con el yodo para formar el monoyoduro.
3 . El oro reacciona con el bromo a 140 ° C para formar el bromuro de oro (III), pero reacciona muy lentamente con el yodo para formar el monoyoduro.
El oro no reacciona directamente con el azufre, pero el sulfuro de oro (III) se puede hacer pasando sulfuro de hidrógeno a través de una solución diluida de cloruro de oro (III) o ácido cloraúrico.
El oro se disuelve fácilmente en el mercurio a temperatura ambiente para formar una amalgama y forma aleaciones con muchos otros metales a temperaturas más altas. Estas aleaciones se pueden producir para modificar la dureza y otras propiedades metalúrgicas, controlar el punto de fusión o crear colores exóticos.
El oro reacciona con potasio, rubidio, cesio o tetrametilamonio, para formar las respectivas sales de auride, que contienen el ion Au. Cesium auride es quizás el más famoso.
El oro no se ve afectado por la mayoría de los ácidos. No reacciona con ácido fluorhídrico, hidroclórico, hidródico, sulfúrico o nítrico. Reacciona con el ácido selenico y se disuelve con aqua regia, una mezcla 1: 3 de ácido nítrico y ácido clorhídrico. El ácido nítrico oxida el metal a +3 iones, pero solo en cantidades diminutas, típicamente indetectables en el ácido puro debido al equilibrio químico de la reacción. Sin embargo, los iones se eliminan del equilibrio mediante ácido clorhídrico, formando iones de AuCl 4 , o ácido cloroáurico, lo que permite una mayor oxidación.
El oro tampoco se ve afectado por la mayoría de las bases. No reacciona con hidróxido de sodio o potasio acuoso, sólido o fundido. Sin embargo, reacciona con cianuro sódico o potásico en condiciones alcalinas cuando hay oxígeno presente para formar complejos solubles.
Los estados de oxidación comunes de oro incluyen +1 (oro (I) o compuestos auro) y +3 (oro (III) o compuestos áuricos). Los iones de oro en solución se reducen fácilmente y se precipitan como metal al agregar cualquier otro metal como agente reductor. El metal añadido se oxida y se disuelve, lo que permite que el oro se desplace de la solución y se recupere como un precipitado sólido.
Raros estados de oxidación
Los estados de oxidación menos comunes de oro incluyen -1, +2 y +5.
El estado de oxidación -1 ocurre en compuestos que contienen el anión Au, llamados aurides. Cesium auride (CsAu), por ejemplo, cristaliza en el motivo del cloruro de cesio. Otros aurides incluyen los de Rb, K, y de tetrametilamonio (CH 3 ) 4 N. El oro tiene la más alta electronegatividad Pauling de cualquier metal, con un valor de 2,54, por lo que el anión Auride relativamente estable.
Compuestos (II) de oro son generalmente diamagnético con Au-Au enlaces tales como [Au (CH 2 ) 2P (C 6 H 5 ) 2 ] 2 Cl 2 . La evaporación de una solución de Au (OH)
3 enHconcentrado
2 SO
4 produce cristales rojos de sulfato de oro (II), Au2(SO4)2. Originalmente se pensó que era un compuesto de valencia mixta, se ha demostrado que contiene cationesAu4+
2 , análogos al ion de mercurio (I) más conocido, Hg2+
2 . Un complejo de oro (II), el catión tetraxenonogold (II), que contiene xenón como ligando, se encuentra en [AuXe4] (Sb2F11)2.
3 enHconcentrado
2 SO
4 produce cristales rojos de sulfato de oro (II), Au2(SO4)2. Originalmente se pensó que era un compuesto de valencia mixta, se ha demostrado que contiene cationesAu4+
2 , análogos al ion de mercurio (I) más conocido, Hg2+
2 . Un complejo de oro (II), el catión tetraxenonogold (II), que contiene xenón como ligando, se encuentra en [AuXe4] (Sb2F11)2.
El pentafluoruro de oro, junto con su anión derivado, AuF -
6 , y su complejo de difluorina, heptafluoruro de oro, es el único ejemplo de oro (V), el estado de oxidación más verificado.
6 , y su complejo de difluorina, heptafluoruro de oro, es el único ejemplo de oro (V), el estado de oxidación más verificado.
Algunos compuestos de oro presentan unión aurófila , que describe la tendencia de los iones de oro a interactuar a distancias que son demasiado largas para ser un enlace Au-Au convencional pero más cortas que las de Van der Waals. Se estima que la interacción es comparable en fuerza a la de un enlace de hidrógeno.
Los compuestos en racimo bien definidos son numerosos. En tales casos, el oro tiene un estado de oxidación fraccional. Un ejemplo representativo es la especie octaédrica {Au (P (C
6 H
5 )
3 )} 6 . Los calcogenuros de oro, como el sulfuro de oro, presentan cantidades iguales de Au (I) y Au (III).
6 H
5 )
3 )} 6 . Los calcogenuros de oro, como el sulfuro de oro, presentan cantidades iguales de Au (I) y Au (III).
Usos medicinales
Las aplicaciones medicinales de oro y sus complejos tienen una larga historia que data de miles de años. Varios complejos de oro se han aplicado para tratar la artritis reumatoide, los más utilizados son: aurotiomalato, aurotioglucosa y auranofina. Tanto los compuestos de oro (I) como de oro (III) han sido investigados como posibles fármacos contra el cáncer. Para los complejos de oro (III), se debe considerar la reducción a oro (0 / I) en condiciones fisiológicas. Se pueden generar complejos estables usando diferentes tipos de sistemas de ligando bi-, tri- y tetradentados y su alta eficacia se ha demostrado in vitro e in vivo.
Orígenes
Teorías de origen celestial
Se cree que el oro se produjo en la nucleosíntesis de supernova y en la colisión de estrellas de neutrones, y que estuvo presente en el polvo del que se formó el Sistema Solar. Debido a que la Tierra estaba fundida cuando se formó, casi todo el oro presente en la Tierra primitiva probablemente se hundió en el núcleo del planeta. Por lo tanto, se cree que la mayor parte del oro que se encuentra en la corteza terrestre y el manto ha sido entregado a la Tierra más tarde, por impactos de asteroides durante el Bombardeo Pesado Tardío, hace unos 4.000 millones de años.
Tradicionalmente, se cree que el oro se formó por el proceso r (captura rápida de neutrones) en la nucleosíntesis de supernova, pero más recientemente se ha sugerido que el oro también puede producir en cantidad el oro y otros elementos más pesados que el hierro. colisión de estrellas de neutrones. En ambos casos, los espectrómetros satelitales solo detectaron indirectamente el oro resultante: "no tenemos evidencia espectroscópica de que [tales] elementos hayan sido realmente producidos", escribió el autor Stephan Rosswog. Sin embargo, en agosto de 2017, las firmas de elementos pesados, incluido el oro, fueron observadas por detectores de ondas gravitacionales y otros observatorios electromagnéticos en el evento de fusión de estrellas de neutrones GW170817. Los modelos astrofísicos actuales sugieren que un solo evento de fusión de estrellas de neutrones generó entre 3 y 13 masas de tierra de oro.
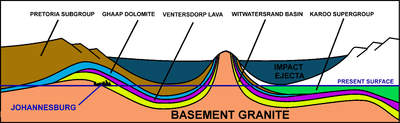
El asteroide que formó el cráter Vredefort hace 2.020 millones de años a menudo se acredita con la siembra de la cuenca de Witwatersrand en Sudáfrica con los depósitos de oro más ricos en la tierra. Sin embargo, las rocas de Witwatersrand con oro se establecieron entre 700 y 950 millones de años antes del impacto de Vredefort. Estas rocas con oro habían sido cubiertas por una gruesa capa de Ventersdorp lavas y el Transvaal Supergrupo de rocas antes de que el meteoro golpeara. Sin embargo, lo que logró el impacto de Vredefort fue distorsionar la cuenca de Witwatersrand de tal manera que las rocas auríferas fueron llevadas a la superficie de erosión actual en Johannesburgo, en el Witwatersrand, justo dentro del borde del cráter original de 300 km de diámetro causado por el golpe de meteorito. El descubrimiento del depósito en 1886 lanzó Witwatersrand Gold Rush.
Orígenes del manto de la tierra
En 2017, un grupo internacional de científicos, entre ellos José María González Jiménez y Ramón y Cajalan, en cooperación con la Universidad de Granada y otras universidades, mientras investigaban los orígenes del oro, estableció históricamente que "llegó a la superficie de la Tierra desde lo más profundo regiones de nuestro planeta ", evidenciado por sus hallazgos en el Macizo del Deseado en la Patagonia argentina.
Ocurrencia
En la Tierra, el oro se encuentra en minerales en rocas formadas desde el tiempo precámbrico en adelante. A menudo ocurre como un metal nativo, típicamente en una solución sólida de metal con plata (es decir, como una aleación de oro y plata). Tales aleaciones generalmente tienen un contenido de plata de 8-10%. Electrum es oro elemental con más de 20% de plata. El color de Electrum va desde dorado plateado a plateado, dependiendo del contenido de plata. Cuanta más plata, menor es la gravedad específica.
El oro nativo se presenta como partículas muy pequeñas o microscópicas incrustadas en la roca, a menudo junto con minerales de cuarzo o sulfuro como el "oro del tonto", que es una pirita. Estos se llaman lodedeposits. El metal en un estado nativo también se encuentra en forma de copos libres, granos o pepitas más grandes que se han erosionado de las rocas y terminan en depósitos aluviales llamados depósitos de placer. Tal oro libre es siempre más rico en la superficie de las vetas auríferas debido a la oxidación de los minerales que lo acompañan, seguido del desgaste y el lavado del polvo en arroyos y ríos, donde se acumula y puede soldarse mediante acción del agua para formar nuggets.
El oro a veces ocurre combinado con telurio como los minerales calaverita, krennerita, nagyagita, petzita y silvanita (ver minerales telururo), y como la rara maldonita bismutida (Au 2 Bi) y aurostibita antimonida (AuSb 2 ). El oro también se produce en aleaciones raras con cobre, plomo y mercurio: los minerales auricupride (Cu 3 Au), novodneprite (AuPb 3 ) y weishanite ((Au, Ag) 3 Hg 2 ).
Investigaciones recientes sugieren que los microbios a veces pueden jugar un papel importante en la formación de depósitos de oro, transportando y precipitando oro para formar granos y nuggets que se acumulan en depósitos aluviales.
Otro estudio reciente ha afirmado que el agua en las fallas se vaporiza durante un terremoto, depositando oro. Cuando ocurre un terremoto, se mueve a lo largo de una falla. El agua a menudo lubrica las fallas, rellenando fracturas y trotando. A unas 6 millas (10 kilómetros) por debajo de la superficie, a temperaturas y presiones increíbles, el agua contiene altas concentraciones de dióxido de carbono, sílice y oro. Durante un terremoto, la sacudida de la falla de repente se abre más. El agua dentro del vacío se vaporiza instantáneamente, pasando a vapor y forzando la sílice, que forma el cuarzo mineral, y el oro de los fluidos y sobre las superficies cercanas.
Agua de mar
Los océanos del mundo contienen oro. Las concentraciones medidas de oro en el Atlántico y el noreste del Pacífico son 50-150 femtomol / L o 10-30 partes por cuatrillón (alrededor de 10-30 g / km). En general, las concentraciones de oro para muestras del Atlántico sur y del Pacífico central son las mismas (~ 50 femtomol / L) pero menos seguras. Las aguas profundas mediterráneas contienen concentraciones de oro ligeramente más altas (100-150 femtomol / L) atribuidas al polvo y / o ríos arrastrados por el viento. Con 10 partes por cuatrillón, los océanos de la Tierra almacenarían 15,000 toneladas de oro. Estas cifras son tres órdenes de magnitud menos de lo reportado en la literatura anterior a 1988, lo que indica problemas de contaminación con los datos anteriores.
Varias personas han afirmado que pueden recuperar económicamente el oro del agua de mar, pero se equivocaron o actuaron de forma intencionada. Prescott Jernegan dirigió una estafa de oro del océano en los Estados Unidos en la década de 1890, al igual que un defraudador inglés a principios del siglo XX. Fritz Haber investigó la extracción de oro del agua de mar en un esfuerzo por ayudar a pagar las reparaciones de Alemania después de la Primera Guerra Mundial. Con base en los valores publicados de 2 a 64 ppb de oro en agua de mar parecía posible una extracción comercialmente exitosa. Después del análisis de 4.000 muestras de agua que arrojaron un promedio de 0.004 ppb quedó claro que la extracción no sería posible y él detuvo el proyecto.
Historia
A partir de 1990, los artefactos de oro encontrados en el cementerio de cuevas de Nahal Qana del 4º milenio antes de Cristo fueron los primeros del Levante. Los artefactos de oro en los Balcanes también aparecen desde el cuarto milenio antes de Cristo, como los encontrados en la Necrópolis de Varna cerca del Lago Varna en Bulgaria, considerado por una fuente (La Niece 2009) como el primer hallazgo "bien fechado" de artefactos de oro. Los artefactos de oro como los sombreros de oro y el disco de Nebra aparecieron en Europa Central a partir del 2. ° milenio antes de Cristo en la Edad de Bronce.
El mapa más antiguo conocido de una mina de oro se dibujó en la Dinastía XIX del Antiguo Egipto (1320-1200 aC), mientras que la primera referencia escrita al oro se registró en la XII Dinastía alrededor de 1900 aC. Los jeroglíficos egipcios de tan temprano como 2600 aC describen el oro, que el rey Tushratta de los mitanni afirmó que era "más abundante que la tierra" en Egipto. Egipto y especialmente Nubia tenían los recursos para convertirlos en las principales áreas productoras de oro durante gran parte de la historia. Uno de los primeros mapas conocidos, conocido como el Mapa del Papiro de Turín, muestra el plan de una mina de oro en Nubia junto con indicaciones de la geología local. Los métodos de trabajo primitivos son descritos por Strabo y Diodorus Siculus, e incluyen el fuego. Grandes minas también estuvieron presentes en todo el Mar Rojo en lo que ahora es Arabia Saudita.
El oro se menciona en las cartas de Amarna numeradas del 19 al 26 del siglo XIV a.
La leyenda del vellón dorado puede referirse al uso de vellones para atrapar el polvo de oro de los depósitos de placer en el mundo antiguo. El oro se menciona con frecuencia en el Antiguo Testamento, comenzando con Génesis 2:11 (en Havilah), la historia de El becerro de oro y muchas partes del templo, incluyendo la Menorá y el altar de oro. En el Nuevo Testamento, se incluye con los dones de los magos en los primeros capítulos de Mateo. El Libro de Apocalipsis 21:21 describe la ciudad de Nueva Jerusalén como calles "hechas de oro puro, claro como el cristal". Se dice que la explotación del oro en la esquina sureste del Mar Negro data de la época de Midas, y este oro fue importante en el establecimiento de lo que probablemente sea la primera acuñación del mundo en Lydiaaround, 610 aC. Desde el siglo sexto o quinto antes de Cristo, el Chu (estado) circuló el Ying Yuan,
En la metalurgia romana, se desarrollaron nuevos métodos para extraer oro a gran escala mediante la introducción de métodos de minería hidráulica, especialmente en Hispania desde el año 25 aC en adelante y en Dacia desde el 106 AD en adelante. Una de sus minas más grandes se encontraba en Las Médulas, en León, donde siete largos acueductos les permitieron depositar la mayor parte de un gran depósito aluvial. Las minas en Roşia Montană en Transilvania también eran muy grandes, y hasta hace muy poco, todavía se extraían por métodos a cielo abierto. También explotaron depósitos más pequeños en Gran Bretaña, como depósitos de placer y roca dura en Dolaucothi. Los diversos métodos que utilizaron fueron bien descritos por Plinio el Viejo en su enciclopedia Naturalis Historia, escrita hacia el final del primer siglo DC.
Durante la peregrinación de Mansa Musa (gobernante del Imperio Malí desde 1312 hasta 1337) a La Meca en 1324, pasó por El Cairo en julio de 1324, y según los informes fue acompañado por un tren de camellos que incluía a miles de personas y casi un centenar de camellos. tanto oro que deprimió el precio en Egipto durante más de una década, causando una alta inflación. Un historiador árabe contemporáneo comentó:
La exploración europea de las Américas se vio impulsada en gran parte por los informes de los ornamentos de oro exhibidos en gran profusión por los pueblos nativos americanos, especialmente en Mesoamérica, Perú, Ecuador y Colombia. Los aztecas consideraban el oro como el producto de los dioses, llamándolo literalmente "excremento de dios" ( teocuitlatl en náhuatl), y después de que mataron a Moctezuma II, la mayor parte de este oro fue enviado a España. Sin embargo, para los pueblos indígenas de América del Norte el oro se consideraba inútil y veían un valor mucho mayor en otros minerales que estaban directamente relacionados con su utilidad, como la obsidiana, el pedernal y la pizarra. Rumores de ciudades llenas de leyendas alimentadas con oro de El Dorado.
El oro jugó un papel en la cultura occidental, como causa del deseo y la corrupción, como se dice en las fábulas infantiles, como Rumpelstiltskin, donde Rumpelstiltskin convierte el heno en oro para la hija del campesino a cambio de su hija cuando se convierte en princesa y el robo de la gallina que pone huevos de oro en Jack and the Beanstalk.
El primer premio en los Juegos Olímpicos y muchas otras competiciones deportivas es la medalla de oro.
El 75% del oro actualmente contabilizado se ha extraído desde 1910. Se ha estimado que la cantidad de oro actualmente conocida internacionalmente formaría un cubo único de 20 m (66 pies) de lado (equivalente a 8,000 m).
Uno de los objetivos principales de los alquimistas era producir oro a partir de otras sustancias, como el plomo, presumiblemente mediante la interacción con una sustancia mítica llamada piedra filosofal. Aunque nunca tuvieron éxito en este intento, los alquimistas promovieron un interés en descubrir sistemáticamente qué se puede hacer con las sustancias, y esto sentó las bases para la química actual. Su símbolo de oro era el círculo con un punto en su centro (☉), que también era el símbolo astrológico y el antiguo carácter chino del Sol.
Se rumorea que los tesoros dorados se encuentran en diversos lugares, tras tragedias como los tesoros del templo judío en el Vaticano, tras la destrucción del templo en el año 70 DC, un alijo de oro en el Titanic , el tren de oro nazi, después de la Segunda Guerra Mundial.
La Cúpula de la Roca está cubierta con un vidrio dorado ultrafino. El templo dorado Sikh, el Harmandir Sahib, es un edificio cubierto de oro. De manera similar, el templo budista esmeralda Wat Phra Kaew (wat) en Tailandia tiene estatuas ornamentales con hojas de oro y techos. Algunas coronas europeas de rey y reina estaban hechas de oro, y el oro se usaba para la corona nupcial desde la antigüedad. Un antiguo texto talmúdico alrededor del año 100 dC describe a Raquel, esposa del rabino Akiva, recibiendo una "Jerusalén de oro" (diadema). Una corona funeraria griega hecha de oro fue encontrada en una tumba alrededor del 370 aC
Etimología
"Oro" está relacionado con palabras similares en muchas lenguas germánicas, derivadas a través de la proto-germánica * gulþą del proto-indoeuropeo * ǵʰelh₃- ("brillar, brillar, ser amarillo o verde").
El símbolo Au es del latín: aurum , la palabra latina para "oro". El antepasado proto-indoeuropeo de aurum era * h₂é-h₂us-o- , que significa "resplandor". Esta palabra deriva de la misma raíz (proto-indoeuropea * h₂u̯es- "al amanecer") como * h₂éu̯sōs , el antepasado de la palabra latina Aurora, "amanecer". Esta relación etimológica está probablemente detrás de la afirmación frecuente en publicaciones científicas de que aurum significaba "alborada brillante".
Cultura
Los grandes logros humanos a menudo se recompensan con oro, en forma de medallas de oro, trofeos de oro y otras decoraciones. Los ganadores de eventos atléticos y otras competiciones calificadas generalmente reciben una medalla de oro. Muchos premios como el Premio Nobel están hechos de oro también. Otras estatuillas y premios de premios están representados en oro o dorados (como los Premios de la Academia, los Globos de Oro, los Premios Emmy, la Palma de Oro y los Premios de la Academia Británica de Cine).
Aristóteles en su ética utilizó el simbolismo del oro al referirse a lo que ahora se conoce como el medio dorado. Del mismo modo, el oro se asocia con principios perfectos o divinos, como en el caso de la proporción áurea y la regla de oro.
El oro se asocia más con la sabiduría del envejecimiento y la fruición. El quincuagésimo aniversario de bodas es oro. Los últimos años más valorados o más exitosos de una persona a veces se consideran "años dorados". La altura de una civilización se conoce como una edad de oro.
En algunas formas de cristianismo y judaísmo, el oro se ha asociado tanto con la santidad como con el mal. En el Libro del Éxodo, el Becerro de Oro es un símbolo de idolatría, mientras que en el Libro del Génesis, se decía que Abraham era rico en oro y plata, y Moisés fue instruido para cubrir la Piedad del Arca del Pacto con pureza oro. En la iconografía bizantina, los halos de Cristo, María y los santos cristianos a menudo son dorados.
Según Cristóbal Colón, aquellos que tenían algo de oro tenían en su posesión algo de gran valor en la Tierra y una sustancia que incluso ayudaría a las almas en el paraíso.
Los anillos de boda han sido hechos de oro. Es duradero y no se ve afectado por el paso del tiempo y puede ayudar en el simbolismo del anillo de los votos eternos ante Dios y la perfección que significa el matrimonio. En las ceremonias de bodas cristianas ortodoxas, la pareja casada está adornada con una corona de oro (aunque algunos optan por coronas, en cambio) durante la ceremonia, una amalgama de ritos simbólicos.
Producción
El Consejo Mundial del Oro afirma que, a partir de finales de 2017, "había 187.200 toneladas de existencias en existencia sobre el suelo". Esto se puede representar mediante un cubo con una longitud de borde de aproximadamente 21 metros. A $ 1,349 por onza troy, 187,200 toneladas métricas de oro tendrían un valor de $ 8,9 billones.
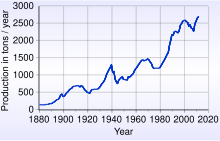
A partir de 2017, el mayor productor de oro del mundo fue China con 455 toneladas. El segundo mayor productor, Australia, extrajo 270 toneladas en el mismo año, seguido de Rusia con 250 toneladas.
Minería y prospección
Desde la década de 1880, Sudáfrica ha sido la fuente de una gran proporción del suministro de oro del mundo, y alrededor del 50% del oro que actualmente se tiene en cuenta es de Sudáfrica. La producción en 1970 representó el 79% de la oferta mundial, alrededor de 1.480 toneladas. En 2007, China (con 276 toneladas) superó a Sudáfrica como el mayor productor de oro del mundo, la primera vez desde 1905 que Sudáfrica no ha sido la más grande.
A partir de 2014, China fue el primer país del mundo en extracción de oro, seguido en orden por Australia, Rusia, Estados Unidos, Canadá y Perú. Sudáfrica, que había dominado la producción mundial de oro durante la mayor parte del siglo XX, había disminuido al sexto lugar. Otros productores importantes son Ghana, Burkina Faso, Malí, Indonesia y Uzbekistán.
En América del Sur, el polémico proyecto Pascua Lama tiene como objetivo la explotación de campos ricos en las altas montañas del desierto de Atacama, en la frontera entre Chile y Argentina.
Hoy, se estima que alrededor de un cuarto de la producción mundial de oro proviene de la minería artesanal o de pequeña escala.
La ciudad de Johannesburgo, ubicada en Sudáfrica, fue fundada como resultado de la fiebre del oro de Witwatersrand, que resultó en el descubrimiento de algunos de los yacimientos de oro natural más grandes de la historia. Los campos de oro están confinados a los bordes norte y noroeste de la cuenca de Witwatersrand, que es una capa de rocas arcaicas de 5-7 km de espesor ubicada, en la mayoría de los lugares, en las profundidades del Estado Libre, Gauteng y las provincias circundantes. Estas rocas de Witwatersrand están expuestas en la superficie del Witwatersrand, en Johannesburgo y sus alrededores, pero también en parcelas aisladas al sureste y sudoeste de Johannesburgo, así como en un arco alrededor del Domo Vredefort, que se encuentra cerca del centro. de la cuenca de Witwatersrand. A partir de estas exposiciones superficiales, la cuenca se sumerge ampliamente, requiriendo que parte de la extracción ocurra a profundidades de casi 4000 m, lo que hace que especialmente las minas Savuka y TauTona al sudoeste de Johannesburgo, las minas más profundas de la tierra. El oro se encuentra solo en seis áreas donde los ríos arcanos del norte y noroeste formaron extensos deltas de ríos trenzados y guijarros antes de desembocar en el "mar de Witwatersrand" donde se depositaron los restos de los sedimentos de Witwatersrand.
La Segunda Guerra Boer de 1899-1901 entre el Imperio Británico y los Afrikaners Boers fue, al menos en parte, sobre los derechos de los mineros y la posesión de la riqueza de oro en Sudáfrica.
Durante el siglo XIX, se produjeron acometidas de oro cuando se descubrieron grandes yacimientos de oro. El primer descubrimiento documentado de oro en los Estados Unidos fue en la Mina de oro Reed cerca de Georgeville, Carolina del Norte en 1803. La primera gran huelga de oro en los Estados Unidos ocurrió en una pequeña ciudad al norte de Georgia llamada Dahlonega. Se produjeron más corrimientos de oro en California, Colorado, Black Hills, Otago en Nueva Zelanda, Australia, Witwatersrand en Sudáfrica y Klondike en Canadá.
Extracción y refinación
| País | 2009 | 2010 | 2011 | 2012 | 2013 |
|---|---|---|---|---|---|
| 442.37 | 745.70 | 986.3 | 864 | 974 | |
| 376.96 | 428.00 | 921.5 | 817.5 | 1120.1 | |
| 150.28 | 128.61 | 199.5 | 161 | 190 | |
| 75.16 | 74.07 | 143 | 118 | 175.2 | |
| 77.75 | 72.95 | 69.1 | 58.5 | 72.2 | |
| 60.12 | 67.50 | 76.7 | 81.9 | 73.3 | |
| 67.60 | 63.37 | 60.9 | 58.1 | 77.1 | |
| 56.68 | 53.43 | 36 | 47.8 | 57.3 | |
| 41.00 | 32.75 | 55 | 52.3 | 68 | |
| 31.75 | 27.35 | 22.6 | 21.1 | 23.4 | |
| Otros países del Golfo Pérsico | 24.10 | 21.97 | 22 | 19.9 | 24.6 |
| 21.85 | 18.50 | -30.1 | 7.6 | 21.3 | |
| 18.83 | 15.87 | 15.5 | 12.1 | 17.5 | |
| 15.08 | 14.36 | 100.8 | 77 | 92.2 | |
| 7.33 | 6.28 | 107.4 | 80.9 | 140.1 | |
| Total | 1508.70 | 1805.60 | |||
| Otros países | 251.6 | 254.0 | 390.4 | 393.5 | 450.7 |
| Total mundial | 1760.3 | 2059.6 | 3487.5 | 3163.6 | 3863.5 |
La extracción de oro es más económica en depósitos grandes, fácilmente extraídos. Las calidades de mineral tan pequeñas como 0.5 partes por millón (ppm) pueden ser económicas. Los grados de mineral típicos en minas a cielo abierto son 1-5 ppm; los grados del mineral en las minas subterráneas o de rocas duras suelen ser de al menos 3 ppm. Debido a que generalmente se necesitan leyes de mineral de 30 ppm antes de que el oro sea visible a simple vista, en la mayoría de las minas de oro el oro es invisible.
Los costos promedio de extracción y extracción de oro fueron de aproximadamente $ 317 por onza troy en 2007, pero estos pueden variar ampliamente según el tipo de extracción y la calidad del mineral; la producción mundial de la mina ascendió a 2.471,1 toneladas.
Después de la producción inicial, el oro a menudo se refina posteriormente industrialmente mediante el proceso Wohlwill que se basa en la electrólisis o mediante el proceso de Miller, es decir, la cloración en la masa fundida. El proceso de Wohlwill produce una mayor pureza, pero es más complejo y solo se aplica en instalaciones de pequeña escala. Otros métodos para analizar y purificar cantidades menores de oro incluyen la separación y la mezcla, así como métodos de copelación o refinación basados en la disolución del oro en agua regia.
Consumo
El consumo de oro producido en el mundo es de aproximadamente 50% en joyería, 40% en inversiones y 10% en industria.
Según el World Gold Council, China es el mayor consumidor de oro del mundo en 2013 y derrocó a India por primera vez, con un aumento del consumo chino del 32 por ciento en un año, mientras que la de India solo aumentó un 13 por ciento y el consumo mundial aumentó en 21 por ciento. A diferencia de India, donde el oro se usa principalmente para joyería, China usa oro para fabricación y venta al por menor.
Contaminación
La producción de oro está asociada con la contribución a la contaminación peligrosa.
El mineral de oro de baja ley puede contener menos de un ppm de oro en el metal; dicho mineral se muele y se mezcla con cianuro de sodio para disolver el oro. El cianuro es un químico altamente venenoso, que puede matar criaturas vivas cuando se expone en cantidades mínimas. Muchos derrames de cianuro de las minas de oro se han producido en países desarrollados y en vías de desarrollo que mataron a la vida acuática en largos tramos de ríos afectados. Los ambientalistas consideran estos eventos como grandes desastres ambientales. Treinta toneladas de mineral usado se vierten como desechos para producir una onza troy de oro. Los vertederos de oro son la fuente de muchos elementos pesados como cadmio, plomo, zinc, cobre, arsénico, selenio y mercurio. Cuando los minerales que contienen sulfuro en estos vertederos de minerales están expuestos al aire y al agua, el sulfuro se transforma en ácido sulfúrico que a su vez disuelve estos metales pesados, facilitando su paso al agua superficial y al agua subterránea. Este proceso se llama drenaje ácido de la mina. Estos vertederos de mineral de oro son residuos altamente peligrosos a largo plazo, en segundo lugar después de los vertederos de residuos nucleares.
Una vez fue común usar mercurio para recuperar oro del mineral, pero hoy en día el uso del mercurio se limita en gran medida a los mineros individuales a pequeña escala. Las cantidades mínimas de compuestos de mercurio pueden llegar a los cuerpos de agua, causando contaminación por metales pesados. El mercurio puede ingresar en la cadena alimentaria humana en forma de metilmercurio. El envenenamiento por mercurio en humanos causa daño incurable en la función cerebral y retraso severo.
La extracción de oro es también una industria altamente intensiva en energía, la extracción de mineral de minas profundas y la molienda de la gran cantidad de mineral para su posterior extracción química requiere casi 25 kW • h de electricidad por gramo de oro producido.
Uso monetario
El oro ha sido ampliamente utilizado en todo el mundo como dinero, para un intercambio indirecto eficiente (frente al trueque) y para almacenar riqueza en reservas. Para fines de intercambio, las casas de moneda producen monedas de lingotes de oro estandarizadas, barras y otras unidades de peso y pureza fijos.
Las primeras monedas conocidas que contienen oro se encontraron en Lydia, Asia Menor, alrededor del año 600 aC. La moneda de talento de oro en uso durante los períodos de la historia griega antes y durante el tiempo de la vida de Homero pesaba entre 8.42 y 8.75 gramos. De una preferencia anterior en el uso de la plata, las economías europeas restablecieron la acuñación de oro como moneda durante los siglos XIII y XIV.
Las cuentas (que maduran en monedas de oro) y los certificados de oro (convertibles en monedas de oro en el banco emisor) se sumaron al stock circulante de oro estándar en la mayoría de las economías industriales del siglo XIX. En preparación para la Primera Guerra Mundial, las naciones beligerantes adoptaron estándares de oro fraccionarios, inflando sus monedas para financiar el esfuerzo bélico. Después de la guerra, los países victoriosos, sobre todo Gran Bretaña, restauraron gradualmente la convertibilidad del oro, pero los flujos internacionales de oro a través de letras de cambio permanecieron embargados; los envíos internacionales se hicieron exclusivamente para intercambios bilaterales o para pagar reparaciones de guerra.
Después de la Segunda Guerra Mundial, el oro fue reemplazado por un sistema de monedas convertibles nominalmente relacionadas por tasas de cambio fijas siguiendo el sistema de Bretton Woods. Las normas de oro y la convertibilidad directa de las monedas al oro han sido abandonadas por los gobiernos mundiales, lideradas en 1971 por la negativa de los Estados Unidos a canjear sus dólares en oro. La moneda Fiat ahora cumple la mayoría de los roles monetarios. Suiza fue el último país en unir su moneda al oro; respaldaba el 40% de su valor hasta que los suizos se unieron al Fondo Monetario Internacional en 1999.
Los bancos centrales continúan conservando una parte de sus reservas líquidas en forma de oro, y las bolsas de metales como la London Bullion Market Association todavía tienen claras las transacciones denominadas en oro, incluidos los futuros contratos de entrega. Hoy, la producción minera de oro está disminuyendo. Con el fuerte crecimiento de las economías en el siglo XX y las divisas crecientes, las reservas mundiales de oro y su mercado comercial se han convertido en una pequeña fracción de todos los mercados y los tipos de cambio fijos de las monedas en oro han sido reemplazados por precios flotantes de oro y oro contrato futuro Aunque el stock de oro crece solo en 1 o 2% por año, muy poco metal se consume irremediablemente. El inventario sobre el suelo satisfaría muchas décadas de usos industriales e incluso artesanales a precios actuales.
La proporción de oro (finura) de las aleaciones se mide por quilates (k). El oro puro (comercialmente denominado oro fino ) se designa como 24 quilates, abreviado 24k. Las monedas de oro inglesas destinadas a la circulación desde 1526 hasta 1930 fueron típicamente una aleación estándar de 22k llamada corona de oro, para dureza (las monedas de oro estadounidenses para circulación después de 1837 contienen una aleación de 0.900 de oro fino, o 21.6 kt).
Aunque los precios de algunos metales del grupo del platino pueden ser mucho más altos, el oro ha sido considerado durante mucho tiempo como el más deseado de los metales preciosos, y su valor se ha utilizado como el estándar para muchas monedas. El oro se ha utilizado como un símbolo de pureza, valor, realeza y, en particular, los roles que combinan estas propiedades. El oro como signo de riqueza y prestigio fue ridiculizado por Thomas More en su tratado Utopía . En esa isla imaginaria, el oro es tan abundante que se usa para hacer cadenas para esclavos, vajillas y asientos de inodoros. Cuando llegan embajadores de otros países, ataviados con ostentosas joyas y joyas de oro, los utopianos los confunden con sirvientes serviles, rindiendo homenaje a los más modestamente vestidos de su partido.
El código de moneda ISO 4217 de oro es XAU. Muchos tenedores de oro lo almacenan en forma de lingotes de monedas o barras como protección contra la inflación u otras perturbaciones económicas. Las monedas de lingotes modernas con fines de inversión o de colección no requieren buenas propiedades de desgaste mecánico; generalmente son de oro fino a 24k, aunque el American Gold Eagle y el soberano de oro británico siguen siendo acuñados en 22k (0.92) metal en la tradición histórica, y el Krugerrand sudafricano, lanzado por primera vez en 1967, también es de 22k (0.92).
El ejemplar especial Canadian Gold Maple Leaf contiene el oro de mayor pureza de cualquier moneda de lingotes, al 99,999% o 0,99999, mientras que el popular ejemplar canadiense Gold Maple Leaf tiene una pureza del 99,99%. En 2006, la Casa de la Moneda de los Estados Unidos comenzó a producir la moneda de lingotes de oro de Buffalo estadounidense con una pureza del 99,99%. Los canguros de oro australianos se acuñaron por primera vez en 1986 como el Nugget de oro australiano, pero cambiaron el diseño inverso en 1989. Otras monedas modernas incluyen la moneda de lingotes de la Filarmónica de Viena austriaca y el panda de oro chino.
Precio
A partir de septiembre de 2017, el oro está valorado en alrededor de $ 42 por gramo ($ 1,300 por onza troy).
Al igual que otros metales preciosos, el oro se mide en peso troy y en gramos. La proporción de oro en la aleación se mide con quilates (k), siendo 24 quilates (24k) el oro puro, y los números de quilates inferiores proporcionalmente menores. La pureza de una barra o moneda de oro también se puede expresar como una cifra decimal que varía de 0 a 1, conocida como la finura millesimal, como 0.995, que es casi pura.
El precio del oro se determina mediante la negociación en los mercados de oro y derivados, pero un procedimiento conocido como Gold Fixing en Londres, que se originó en septiembre de 1919, proporciona un precio diario de referencia para la industria. La fijación de la tarde se introdujo en 1968 para proporcionar un precio cuando los mercados de EE. UU. Están abiertos.
Historia
Históricamente, las monedas de oro se usaban ampliamente como moneda; cuando se introdujo el papel moneda, normalmente era un recibo canjeable por monedas de oro o lingotes. En un sistema monetario conocido como el estándar de oro, un determinado peso de oro recibió el nombre de una unidad de moneda. Durante un período prolongado, el gobierno de los Estados Unidos estableció el valor del dólar estadounidense para que una onza troy fuera igual a $ 20.67 ($ 0.665 por gramo), pero en 1934 el dólar se devaluó a $ 35.00 por onza troy ($ 0.889 / g). En 1961, se estaba haciendo difícil mantener este precio, y un grupo de bancos estadounidenses y europeos acordaron manipular el mercado para evitar una mayor devaluación de la moneda frente al aumento de la demanda de oro.
El 17 de marzo de 1968, las circunstancias económicas causaron el colapso del grupo de oro, y se estableció un esquema de precios de dos niveles por el cual el oro todavía se usaba para liquidar cuentas internacionales al viejo $ 35.00 por onza troy ($ 1.13 / g) pero el precio de el oro en el mercado privado se permitió fluctuar; este sistema de precios de dos niveles fue abandonado en 1975 cuando se dejó el precio del oro para encontrar su nivel de libre mercado. Los bancos centrales todavía conservan las reservas históricas de oro como una reserva de valor, aunque el nivel generalmente ha disminuido. El depósito de oro más grande del mundo es el del Banco de la Reserva Federal de EE. UU. En Nueva York, que posee alrededor del 3% del oro que se sabe que existe y representa hoy, al igual que el Depósito de lingotes estadounidense cargado de manera similar en Fort Knox. En 2005, el Consejo Mundial del Oro estimó que el suministro global de oro total sería 3,
Después del choque de Nixon del 15 de agosto de 1971, el precio comenzó a aumentar enormemente, y entre 1968 y 2000 el precio del oro varió ampliamente, desde un máximo de $ 850 por onza troy ($ 27.33 / g) el 21 de enero de 1980, a un mínimo de $ 252.90 por onza troy ($ 8.13 / g) el 21 de junio de 1999 (London Gold Fixing). Los precios aumentaron rápidamente desde 2001, pero el máximo de 1980 no se superó hasta el 3 de enero de 2008, cuando se estableció un nuevo máximo de $ 865.35 por onza troy. Otro precio récord se fijó el 17 de marzo de 2008, a $ 1023.50 por onza troy ($ 32.91 / g).
A fines de 2009, los mercados del oro experimentaron un impulso renovado al alza debido al aumento de la demanda y al debilitamiento del dólar estadounidense. El 2 de diciembre de 2009, el oro alcanzó un nuevo cierre alto en $ 1,217.23. El oro se recuperó aún más alcanzando nuevos máximos en mayo de 2010 después de que la crisis de la deuda de la Unión Europea provocó una mayor compra de oro como un activo seguro. El 1 de marzo de 2011, el oro alcanzó un nuevo máximo histórico de $ 1432.57, en base a las preocupaciones de los inversionistas con respecto a los disturbios en curso en el norte de África, así como en Oriente Medio.
Desde abril de 2001 hasta agosto de 2011, los precios spot del oro se quintuplicaron en valor con respecto al dólar estadounidense, alcanzando un nuevo récord histórico de $ 1,913.50 el 23 de agosto de 2011, lo que provocó especulaciones de que el mercado bajista secular había terminado y había un mercado alcista devuelto. Sin embargo, el precio comenzó a declinar lentamente hacia $ 1200 por onza troy a finales de 2014 y 2015.
Otras aplicaciones
Joyería
Debido a la suavidad del oro puro (24k), por lo general se alea con metales base para su uso en joyería, alterando su dureza y ductilidad, punto de fusión, color y otras propiedades. Las aleaciones con menor índice de quilates, típicamente 22k, 18k, 14k o 10k, contienen mayores porcentajes de cobre u otros metales base o plata o paladio en la aleación. El níquel es tóxico, y su liberación del oro blanco de níquel está controlada por la legislación en Europa. Las aleaciones de paladio y oro son más caras que las que usan níquel. Las aleaciones de oro blanco de alto quilate son más resistentes a la corrosión que la plata pura o la plata de ley. La embarcación japonesa de Mokume-gane explota los contrastes de color entre las aleaciones de oro laminadas para producir efectos decorativos de grano de madera.
Para 2014, la industria de la joyería de oro estaba escalando a pesar de una caída en los precios del oro. La demanda en el primer trimestre de 2014 impulsó la facturación a $ 23,7 mil millones según un informe del Consejo Mundial del Oro.
La soldadura de oro se utiliza para unir los componentes de joyería de oro mediante soldadura dura a alta temperatura o soldadura fuerte. Si el trabajo debe ser de calidad distintiva, la aleación de soldadura de oro debe coincidir con la finura (pureza) del trabajo, y las fórmulas de aleación se fabrican para igualar el color del oro amarillo y blanco. La soldadura de oro generalmente se fabrica en al menos tres rangos de punto de fusión conocidos como Fácil, Medio y Difícil. Al usar primero la soldadura dura de punto de fusión alto, seguida de las soldaduras con puntos de fusión progresivamente más bajos, los orfebres pueden ensamblar elementos complejos con varias juntas soldadas separadas. El oro también se puede hacer en hilo y usar en bordado.
Electrónica
Solo el 10% del consumo mundial de oro nuevo se destina a la industria, pero el uso industrial más importante para el oro nuevo es la fabricación de conectores eléctricos libres de corrosión en computadoras y otros dispositivos eléctricos. Por ejemplo, según el World Gold Council, un teléfono celular típico puede contener 50 mg de oro, por valor de aproximadamente 50 centavos. Pero dado que se producen casi mil millones de teléfonos celulares cada año, un valor de oro de 50 centavos en cada teléfono se suma a los $ 500 millones en oro de esta aplicación.
Aunque el oro es atacado por cloro libre, su buena conductividad y resistencia general a la oxidación y corrosión en otros ambientes (incluida la resistencia a ácidos no clorados) ha llevado a su uso industrial generalizado en la era electrónica como un recubrimiento de capa delgada en conectores eléctricos , asegurando así una buena conexión. Por ejemplo, el oro se usa en los conectores de los cables electrónicos más caros, como los cables de audio, video y USB. El beneficio de usar oro sobre otros metales conectores como el estaño en estas aplicaciones ha sido debatido; los conectores de oro son a menudo criticados por los expertos en audiovisuales como innecesarios para la mayoría de los consumidores y vistos simplemente como una estratagema de marketing. Sin embargo, el uso de oro en otras aplicaciones en contactos deslizantes electrónicos en atmósferas altamente húmedas o corrosivas,
Además de los contactos eléctricos deslizantes, el oro también se utiliza en contactos eléctricos debido a su resistencia a la corrosión, conductividad eléctrica, ductilidad y falta de toxicidad. Los contactos del interruptor generalmente están sujetos a una tensión de corrosión más intensa que los contactos deslizantes. Los alambres finos de oro se utilizan para conectar dispositivos semiconductores a sus paquetes a través de un proceso conocido como enlace de cables.
La concentración de electrones libres en metal dorado es de 5,91 × 10 cm. El oro es altamente conductivo para la electricidad y se ha utilizado para el cableado eléctrico en algunas aplicaciones de alta energía (solo la plata y el cobre son más conductivos por volumen, pero el oro tiene la ventaja de la resistencia a la corrosión). Por ejemplo, se usaron cables eléctricos de oro durante algunos de los experimentos atómicos del Proyecto Manhattan, pero se usaron grandes cables de plata de alta corriente en los imanes separadores de isótopos de calutrón en el proyecto.
Se estima que el 16% del oro del mundo y el 22% de la plata del mundo están contenidos en tecnología electrónica en Japón.
Medicina
Los compuestos metálicos y de oro se han utilizado durante mucho tiempo con fines medicinales. El oro, usualmente como el metal, es quizás la medicina administrada más antiguamente (aparentemente por los practicantes chamánicos) y conocida por Dioscórides. En la época medieval, el oro se veía a menudo como beneficioso para la salud, en la creencia de que algo tan raro y hermoso no podía ser otra cosa que saludable. Incluso algunos esoteristas modernos y formas de medicina alternativa asignan al oro metálico un poder curativo.
En el siglo XIX, el oro tenía la reputación de ser un "nervine", una terapia para los trastornos nerviosos. La depresión, la epilepsia, la migraña y los problemas glandulares, como la amenorrea y la impotencia, fueron tratados, y más notablemente el alcoholismo (Keeley, 1897).
La aparente paradoja de la toxicología real de la sustancia sugiere la posibilidad de lagunas serias en la comprensión de la acción del oro en la fisiología. Solo las sales y los radioisótopos de oro son de valor farmacológico, ya que el oro elemental (metálico) es inerte para todas las sustancias químicas que encuentra dentro del cuerpo (es decir, el ácido ingerido no puede atacar el oro ingerido). Algunas sales de oro tienen propiedades antiinflamatorias y en la actualidad todavía se usan dos como productos farmacéuticos en el tratamiento de la artritis y otras afecciones similares en los EE. UU. (Aurotiomalato de sodio y auranofina). Estos medicamentos han sido explorados como un medio para ayudar a reducir el dolor y la hinchazón de la artritis reumatoide, y también (históricamente) contra la tuberculosis y algunos parásitos.
Las aleaciones de oro se utilizan en odontología restauradora, especialmente en restauraciones dentales, como coronas y puentes permanentes. La ligera maleabilidad de las aleaciones de oro facilita la creación de una superficie de acoplamiento molar superior con otros dientes y produce resultados que generalmente son más satisfactorios que los producidos por la creación de coronas de porcelana. El uso de coronas de oro en dientes más prominentes, como los incisivos, se ve favorecido en algunas culturas y desaconsejado en otras.
Las preparaciones coloidales de oro (suspensiones de nanopartículas de oro) en el agua son de color rojo intenso, y pueden fabricarse con tamaños de partículas estrictamente controlados de hasta unas pocas decenas de nanómetros de diámetro mediante la reducción del cloruro de oro con citrato o iones de ascorbato. El oro coloidal se utiliza en aplicaciones de investigación en medicina, biología y ciencia de los materiales. La técnica de etiquetado de inmunogloboximplica la capacidad de las partículas de oro para adsorber moléculas de proteínas en sus superficies. Las partículas de oro coloidal recubiertas con anticuerpos específicos pueden usarse como sondas para la presencia y posición de antígenos en las superficies de las células. En secciones ultrafinas de tejidos vistos por microscopía electrónica, las etiquetas de inmuno-oro aparecen como puntos redondos extremadamente densos en la posición del antígeno.
El oro, o aleaciones de oro y paladio, se aplican como revestimiento conductivo a muestras biológicas y otros materiales no conductores, como plásticos y vidrio, para que se puedan ver en un microscopio electrónico de barrido. El revestimiento, que generalmente se aplica mediante pulverización catódica con un plasma de argón, tiene un triple papel en esta aplicación. La conductividad eléctrica muy alta del oro drena la carga eléctrica a la tierra, y su densidad muy alta proporciona potencia de frenado para los electrones en el haz de electrones, lo que ayuda a limitar la profundidad a la que el haz de electrones penetra la muestra. Esto mejora la definición de la posición y la topografía de la superficie de la muestra y aumenta la resolución espacial de la imagen. El oro también produce un alto rendimiento de electrones secundarios cuando se irradia con un haz de electrones.
El isótopo gold-198 (vida media de 2.7 días) se usa, en medicina nuclear, en algunos tratamientos contra el cáncer y para tratar otras enfermedades.
Cocina
- El oro puede utilizarse en alimentos y tiene el número E 175. En 2016, la Autoridad Europea de Seguridad Alimentaria publicó una opinión sobre la reevaluación del oro como aditivo alimentario. Las preocupaciones incluyeron la posible presencia de pequeñas cantidades de nanopartículas de oro en el aditivo alimentario, y que las nanopartículas de oro han demostrado ser genotóxicas en células de mamíferos in vitro.
- La hoja de oro, las escamas o el polvo se utilizan en y en algunos alimentos gourmet, especialmente los dulces y las bebidas como ingrediente decorativo. La nobleza usó la hojuela de oro en la Europa medieval como decoración en alimentos y bebidas, en forma de hojas, copos o polvo, para demostrar la riqueza del anfitrión o en la creencia de que algo valioso y raro debe ser beneficioso para la salud .
- Danziger Goldwasser (alemán: agua de oro de Danzig) o Goldwasser (inglés: Goldwater ) es un licor de hierbas tradicional alemán producido en lo que hoy es Gdańsk, Polonia, y Schwabach, Alemania, y contiene hojuelas de pan de oro. También hay algunos cócteles caros (c. $ 1000) que contienen copos de pan de oro. Sin embargo, dado que el oro metálico es inerte para la química de todo el cuerpo, no tiene sabor, no proporciona nutrición y deja el cuerpo inalterado.
- Vark es una lámina compuesta por un metal puro que a veces es dorado, y se usa para adornar dulces en la cocina del sur de Asia.
Miscelánea
- El oro produce un color rojo profundo e intenso cuando se usa como un agente colorante en el vidrio de arándano.
- En fotografía, los tóners dorados se utilizan para cambiar el color de las impresiones en blanco y negro de bromuro de plata hacia tonos marrones o azules o para aumentar su estabilidad. Utilizado en impresiones en tonos sepia, los tones dorados producen tonos rojos. Kodak publicó fórmulas para varios tipos de tóneres de oro, que usan oro como cloruro.
- El oro es un buen reflector de la radiación electromagnética, como la luz infrarroja y visible, así como las ondas de radio. Se utiliza para revestimientos protectores en muchos satélites artificiales, en placas frontales de protección infrarroja en trajes de protección térmica y cascos de astronautas, y en aviones de guerra electrónica como el EA-6B Prowler.
- El oro se usa como capa reflectante en algunos CD de gama alta.
- Los automóviles pueden usar oro para protegerse contra el calor. McLaren usa lámina de oro en el compartimiento del motor de su modelo F1.
- El oro puede fabricarse tan delgado que parece semitransparente. Se usa en algunas ventanas de cabina de aeronaves para deshielo o anticongelante al pasar electricidad a través de él. El calor producido por la resistencia del oro es suficiente para evitar la formación de hielo.
- El oro es atacado y se disuelve en soluciones alcalinas de cianuro de potasio o sodio, para formar el cianuro de oro salado, una técnica que se ha utilizado para extraer oro metálico de minerales en el proceso de cianuro. El cianuro de oro es el electrolito utilizado en la galvanoplastia comercial de oro en metales básicos y electroformado.
- Las soluciones de cloruro de oro (ácido cloroáurico) se utilizan para hacer oro coloidal por reducción con citrato o iones de ascorbato. El cloruro de oro y el óxido de oro se utilizan para hacer arándanos o vidrio de color rojo, que, al igual que las suspensiones de oro coloidal, contiene nanopartículas de oro esféricas de tamaño uniforme.
- El oro, cuando se dispersa en nanopartículas, puede actuar como un catalizador heterogéneo de reacciones químicas.
Toxicidad
El oro metálico puro (elemental) no es tóxico y no irrita cuando se ingiere, y algunas veces se usa como decoración de alimentos en forma de pan de oro. El oro metálico también es un componente de las bebidas alcohólicas Goldschläger, Gold Strike y Goldwasser. El oro metálico está aprobado como aditivo alimentario en la UE (E175 en el Codex Alimentarius). Aunque el ion de oro es tóxico, la aceptación del oro metálico como aditivo alimentario se debe a su inercia química relativa y a la resistencia a corroerse o transformarse en sales solubles (compuestos de oro) por cualquier proceso químico conocido que se encontraría en el ser humano cuerpo.
Los compuestos solubles (sales de oro) como el cloruro de oro son tóxicos para el hígado y los riñones. Las sales de cianuro comunes de oro, como el cianuro de potasio y oro, que se utilizan en la galvanoplastia de oro, son tóxicas en virtud de su contenido de oro y cianuro. Hay casos raros de envenenamiento por oro letal a partir de cianuro de potasio y oro. La toxicidad del oro puede mejorarse con terapia de quelación con un agente como dimercaprol.
El metal dorado fue elegido alérgeno del año en 2001 por la American Contact Dermatitis Society, las alergias por contacto con el oro afectan principalmente a las mujeres. A pesar de esto, el oro es un alergeno de contacto relativamente no potente, en comparación con metales como el níquel.
Una muestra del hongo Aspergillus niger se encontró creciendo a partir de la solución de extracción de oro; y se encontró que contenía complejos de ciano metal; como oro, plata, cobre, hierro y zinc. El hongo también juega un papel en la solubilización de sulfuros de metales pesados.