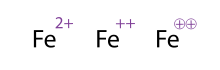Ion
Definición
Un ion ( / aɪ ɒ n ,Los iones que consisten en un solo átomo se denominan iones atómicos o monatómicos, mientras que dos o más átomos forman iones moleculares o iones poliatómicos. En el caso de la ionización física en un medio, como un gas, se crean "pares de iones" mediante colisiones de iones, donde cada par generado consta de un electrón libre y un ion positivo. Los iones también se crean por interacciones químicas, como la disolución de sales en líquidos o por otros medios, como pasar una corriente directa a través de una solución conductora, disolver un ánodo mediante ionización.
Historia de descubrimiento
La palabra ion proviene de la palabra griega ἰόν, ion , "going", el presente participio de ἰέναι, ienai , "to go". Este término fue introducido por el físico y químico inglés Michael Faraday en 1834 para la especie entonces desconocida que va de un electrodo a otro a través de un medio acuoso. Faraday no conocía la naturaleza de estas especies, pero sabía que, dado que los metales se disolvían y entraban en una solución en un electrodo, surgía un nuevo metal de una solución en el otro electrodo; que algún tipo de sustancia se ha movido a través de la solución en una corriente. Esto transporta materia de un lugar a otro.
Faraday también introdujo las palabras anión para un ion con carga negativa y el catión para uno con carga positiva. En la nomenclatura de Faraday, los cationes se llamaron porque fueron atraídos por el cátodo en un dispositivo galvánico y los aniones fueron nombrados debido a su atracción al ánodo.
Svante Arrhenius presentó, en su disertación de 1884, su explicación del hecho de que las sales cristalinas sólidas se disocian en partículas cargadas cuando se disolvieron, por lo que ganaría el Premio Nobel de Química de 1903. La explicación de Arrhenius fue que al formar una solución, la sal se disocia en los iones de Faraday. Arrhenius propuso que los iones se formaran incluso en ausencia de una corriente eléctrica.
Características
Los iones en estado gaseoso son altamente reactivos e interactúan rápidamente con iones de carga opuesta para dar moléculas neutras o sales iónicas. Los iones también se producen en estado líquido o sólido cuando las sales interactúan con solventes (por ejemplo, agua) para producir "iones solvatados", que son más estables, por razones que implican una combinación de cambios de energía y entropía a medida que los iones se alejan de cada uno otro para interactuar con el liquido Estas especies estabilizadas se encuentran más comúnmente en el ambiente a bajas temperaturas. Un ejemplo común son los iones presentes en el agua de mar, que se derivan de las sales disueltas.
Todos los iones se cargan, lo que significa que, como todos los objetos cargados, son:
- atraído por cargas eléctricas opuestas (positivo a negativo, y viceversa),
- repelido por cargos similares
- al moverse, sus trayectorias pueden ser desviadas por un campo magnético.
Los electrones, debido a su masa más pequeña y, por lo tanto, a sus propiedades de relleno de espacio más grandes que las ondas de materia, determinan el tamaño de los átomos y moléculas que poseen algún tipo de electrones. Por lo tanto, los aniones (iones cargados negativamente) son más grandes que la molécula o átomo padre, ya que los electrones en exceso se repelen entre sí y se agregan al tamaño físico del ion, porque su tamaño está determinado por su nube de electrones. Como tal, en general, los cationes son más pequeños que el átomo o molécula padre correspondiente debido al menor tamaño de su nube de electrones. Un catión particular (el de hidrógeno) no contiene electrones y, por lo tanto, consiste en un único protón, mucho más pequeño que el átomo de hidrógeno original.
Aniones y cationes
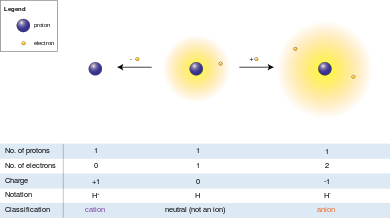
Dado que la carga eléctrica en un protón es igual en magnitud a la carga en un electrón, la carga eléctrica neta en un ion es igual a la cantidad de protones en el ion menos la cantidad de electrones.
Una de aniones (-) ( / æ n . Aɪ . Ən / ), de la palabra griega ἄνω ( ANO ), que significa "arriba", es un ion con más electrones que protones, lo que supone una carga neta negativa (ya que los electrones son cargados negativamente y los protones tienen carga positiva).
Un catión de (+) ( / k æ t . Aɪ . Ən / ), de la palabra griega κάτω ( Káto ), lo que significa "abajo", es un ion con menos electrones que protones, lo que supone una carga positiva.
Hay nombres adicionales usados para iones con cargas múltiples. Por ejemplo, un ion con una carga -2 se conoce como dianión y un ion con una carga +2 se conoce como dicación. Un zwitterion es una molécula neutra con cargas positivas y negativas en diferentes lugares dentro de esa molécula.
Los cationes y aniones se miden por su radio iónico y difieren en tamaño relativo: "Los cationes son pequeños, la mayoría de ellos tienen menos de 10 m (10 cm) de radio. Pero la mayoría de los aniones son grandes, como el anión terrestre más común, el oxígeno A partir de este hecho, es evidente que el anión ocupa la mayor parte del espacio de un cristal y que los cationes encajan en los espacios que los separan ".
Un catión tiene un radio menor a 0.8 × 10 m (0.8 Å) mientras que un anión tiene un radio mayor a 1.3 × 10 m (1.3 Å).
Ocurrencias naturales
Los iones son de naturaleza omnipresente y son responsables de diversos fenómenos, desde la luminiscencia del Sol hasta la existencia de la ionosfera de la Tierra. Los átomos en su estado iónico pueden tener un color diferente de los átomos neutros, y por lo tanto la absorción de la luz por los iones metálicos da el color de las piedras preciosas. Tanto en química inorgánica como orgánica (incluida la bioquímica), la interacción del agua y los iones es extremadamente importante; un ejemplo es la energía que impulsa la descomposición del trifosfato de adenosina (ATP). Las siguientes secciones describen contextos en los que los iones aparecen prominentemente; estos están dispuestos en una escala de longitud física decreciente, desde lo astronómico hasta lo microscópico.
Tecnología relacionada
Los iones pueden prepararse no químicamente utilizando varias fuentes de iones, que generalmente involucran alto voltaje o temperatura. Estos se utilizan en una multitud de dispositivos tales como espectrómetros de masas, espectrómetros de emisión óptica, aceleradores de partículas, implantadores de iones y motores de iones.
Como partículas cargadas reactivas, también se usan en la purificación del aire al alterar los microbios y en artículos domésticos como los detectores de humo.
Como la señalización y el metabolismo en los organismos están controlados por un gradiente iónico preciso a través de las membranas, la alteración de este gradiente contribuye a la muerte celular. Este es un mecanismo común explotado por biocidas naturales y artificiales, incluidos los canales iónicos gramicidina y anfotericina (un fungicida).
Los iones disueltos inorgánicos son un componente del total de sólidos disueltos, un indicador ampliamente conocido de la calidad del agua.
Detección de radiación ionizante
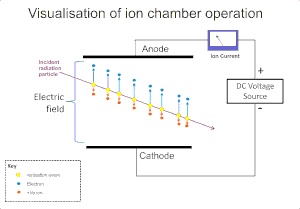
El efecto ionizante de la radiación en un gas se usa ampliamente para la detección de radiación, como alfa, beta, gamma y rayos X. El evento de ionización original en estos instrumentos da como resultado la formación de un "par de iones"; un ion positivo y un electrón libre, por impacto de iones por la radiación en las moléculas de gas. La cámara de ionización es el más simple de estos detectores, y recoge todas las cargas creadas por la ionización directa dentro del gas mediante la aplicación de un campo eléctrico.
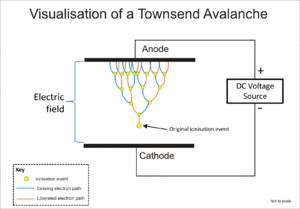
El tubo Geiger-Müller y el contador proporcional usan un fenómeno conocido como avalancha de Townsend para multiplicar el efecto del evento ionizante original mediante un efecto de cascada mediante el cual los electrones libres reciben suficiente energía del campo eléctrico para liberar más electrones mediante impacto de iones
Química
Notación
Denotando el estado cargado
Al escribir la fórmula química de un ion, su carga neta se escribe en superíndice inmediatamente después de la estructura química de la molécula / átomo. La carga neta se escribe con la magnitud antes del signo; es decir, un catión con doble carga se indica como 2+ en lugar de +2 . Sin embargo, la magnitud de la carga se omite para moléculas / átomos con carga simple; por ejemplo, el catión de sodio se indica como Na y no Na.
Una forma alternativa (y aceptable) de mostrar una molécula / átomo con cargas múltiples es dibujar los signos varias veces, esto se ve a menudo con los metales de transición. Los químicos a veces rodean el cartel; esto es meramente ornamental y no altera el significado químico. Las tres representaciones de Fe 2+
que se muestra en la figura, son por lo tanto equivalentes.
que se muestra en la figura, son por lo tanto equivalentes.
Los iones monoatómicos a veces también se denotan con números romanos; por ejemplo, el Fe 2+
el ejemplo visto anteriormente se denomina ocasionalmente Fe (II) o Fe. El número romano designa el estado de oxidación formal de un elemento, mientras que los números superpuestos denotan la carga neta. Las dos notaciones son, por lo tanto, intercambiables por iones monoatómicos, pero los números romanos no se pueden aplicar a iones poliatómicos. Sin embargo, es posible mezclar las notaciones para el centro de metal individual con un complejo poliatómico, como se muestra en el ejemplo del ion uranilo.
el ejemplo visto anteriormente se denomina ocasionalmente Fe (II) o Fe. El número romano designa el estado de oxidación formal de un elemento, mientras que los números superpuestos denotan la carga neta. Las dos notaciones son, por lo tanto, intercambiables por iones monoatómicos, pero los números romanos no se pueden aplicar a iones poliatómicos. Sin embargo, es posible mezclar las notaciones para el centro de metal individual con un complejo poliatómico, como se muestra en el ejemplo del ion uranilo.
Subclases
Si un ion contiene electrones desapareados, se llama ion radical. Al igual que los radicales libres, los iones radicales son muy reactivos. Los iones poliatómicos que contienen oxígeno, como el carbonato y el sulfato, se llaman oxianiones . Los iones moleculares que contienen al menos un enlace carbono a hidrógeno se llaman iones orgánicos . Si la carga en un ion orgánico se centra formalmente en un carbono, se denomina carbocatión (si está cargada positivamente) o carbanión (si está cargada negativamente).
Formación
Formación de iones monoatómicos
Los iones monatómicos están formados por la ganancia o pérdida de electrones en la capa de valencia (la capa exterior de electrones) en un átomo. Las capas internas de un átomo están llenas de electrones que están estrechamente ligados al núcleo atómico con carga positiva, y por lo tanto no participan en este tipo de interacción química. El proceso de ganar o perder electrones de un átomo o molécula neutral se llama ionización .
Los átomos se pueden ionizar mediante bombardeo con radiación, pero el proceso más habitual de ionización que se encuentra en la química es la transferencia de electrones entre átomos o moléculas. Esta transferencia generalmente se lleva a cabo mediante el logro de configuraciones electrónicas estables ("carcasa cerrada"). Los átomos ganarán o perderán electrones dependiendo de qué acción tome la menor energía.
Por ejemplo, un átomo de sodio, Na, tiene un solo electrón en su capa de valencia, que rodea 2 caparazones internos estables y rellenos de 2 y 8 electrones. Dado que estos caparazones llenos son muy estables, un átomo de sodio tiende a perder su electrón extra y lograr esta configuración estable, convirtiéndose en un catión de sodio en el proceso.
- Na → Na + + e -
Por otro lado, un átomo de cloro, Cl, tiene 7 electrones en su capa de valencia, que es una corta de la capa estable, llena con 8 electrones. Por lo tanto, un átomo de cloro tiende a ganar un electrón extra y lograr una configuración estable de 8 electrones, convirtiéndose en un anión cloruro en el proceso:
- Cl + e - → Cl -
Esta fuerza motriz es lo que hace que el sodio y el cloro experimenten una reacción química, en donde el electrón "extra" se transfiere de sodio a cloro, formando cationes de sodio y aniones de cloruro. Al tener cargas opuestas, estos cationes y aniones forman enlaces iónicos y se combinan para formar cloruro de sodio, NaCl, más comúnmente conocido como sal de mesa.
- Na + + Cl - → NaCl
Formación de iones poliatómicos y moleculares
Los iones poliatómicos y moleculares a menudo se forman al ganar o perder iones elementales, como un protón, H, en moléculas neutras. Por ejemplo, cuando el amoníaco, NH 3 , acepta un protón, el proceso H-a llamado protonación, forma el ion amonio, NH 4 . El amoníaco y el amonio tienen el mismo número de electrones en la misma configuración electrónica, pero el amonio tiene un protón adicional que le da una carga neta positiva.
El amoníaco también puede perder un electrón para obtener una carga positiva, formando el ion • NH +
3 . Sin embargo, este ion es inestable, porque tiene una capa de valencia incompleta alrededor del átomo de nitrógeno, lo que lo convierte en un ion radical muy reactivo.
3 . Sin embargo, este ion es inestable, porque tiene una capa de valencia incompleta alrededor del átomo de nitrógeno, lo que lo convierte en un ion radical muy reactivo.
Debido a la inestabilidad de los iones radicales, los iones poliatómicos y moleculares generalmente se forman al ganar o perder iones elementales como H +
, en lugar de ganar o perder electrones. Esto permite a la molécula conservar su configuración electrónica estable mientras adquiere una carga eléctrica.
, en lugar de ganar o perder electrones. Esto permite a la molécula conservar su configuración electrónica estable mientras adquiere una carga eléctrica.
Potencial de ionización
La energía requerida para separar un electrón en su estado de energía más bajo a partir de un átomo o molécula de un gas con menos carga eléctrica neta se denomina potencial de ionización o energía de ionización . La n ° energía de ionización de un átomo es la energía requerida para separar su n ° electrón después de que los primeros n - 1 electrones ya han sido separados.
Cada energía de ionización sucesiva es marcadamente mayor que la anterior. Se producen aumentos particularmente grandes después de que un bloque dado de orbitales atómicos se agote de electrones. Por esta razón, los iones tienden a formarse de manera que los dejan con bloques orbitales completos. Por ejemplo, el sodio tiene un electrón de valencia en su capa más externa, por lo que en forma ionizada se encuentra comúnmente con un electrón perdido, como Na +
. En el otro lado de la tabla periódica, el cloro tiene siete electrones de valencia, por lo que en forma ionizada se encuentra comúnmente con un electrón ganado, como Cl -
. El cesio tiene la menor energía de ionización medida de todos los elementos y el helio tiene la mayor. En general, la energía de ionización de los metales es mucho más baja que la energía de ionización de los no metales, por lo que, en general, los metales perderán electrones para formar iones cargados positivamente y los no metales ganarán electrones para formar iones cargados negativamente.
. En el otro lado de la tabla periódica, el cloro tiene siete electrones de valencia, por lo que en forma ionizada se encuentra comúnmente con un electrón ganado, como Cl -
. El cesio tiene la menor energía de ionización medida de todos los elementos y el helio tiene la mayor. En general, la energía de ionización de los metales es mucho más baja que la energía de ionización de los no metales, por lo que, en general, los metales perderán electrones para formar iones cargados positivamente y los no metales ganarán electrones para formar iones cargados negativamente.
Enlace iónico
La unión iónica es un tipo de enlace químico que surge de la atracción mutua de iones de carga opuesta. Iones de carga similar se repelen entre sí, y los iones de carga opuesta se atraen entre sí. Por lo tanto, los iones no suelen existir por sí solos, sino que se unen con iones de carga opuesta para formar una red cristalina. El compuesto resultante se llama compuesto iónico y se dice que se mantiene unido por enlace iónico . En los compuestos iónicos surgen distancias características entre los vecinos iónicos a partir de los cuales pueden derivarse la extensión espacial y el radio iónico de los iones individuales.
El tipo más común de enlace iónico se ve en compuestos de metales y no metales (excepto gases nobles, que rara vez forman compuestos químicos). Los metales se caracterizan por tener una pequeña cantidad de electrones en exceso de una configuración electrónica estable de carcasa cerrada. Como tal, tienen la tendencia a perder estos electrones adicionales para lograr una configuración estable. Esta propiedad se conoce como electropositividad . Los no metales, por otro lado, se caracterizan por tener una configuración de electrones con solo unos pocos electrones menos que una configuración estable. Como tal, tienen la tendencia de ganar más electrones para lograr una configuración estable. Esta tendencia se conoce como electronegatividad. Cuando un metal altamente electropositivo se combina con un no metal muy electronegativo, los electrones extra de los átomos de metal se transfieren a los átomos no metálicos deficientes en electrones. Esta reacción produce cationes metálicos y aniones no metálicos, que se atraen entre sí para formar una sal .
Iones comunes
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Obtenido de: https://en.wikipedia.org/wiki/Ion