Antibiótico
Definición
| Antibiótico | |
|---|---|
| Clase de drogas | |
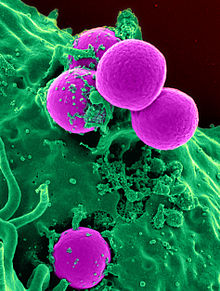
 Prueba de la susceptibilidad de Staphylococcus aureus a los antibióticos mediante el método de difusión de disco de Kirby-Bauer: los antibióticos se difunden de los discos que contienen antibióticos e inhiben el crecimiento de S. aureus , lo que resulta en una zona de inhibición. | |
| En Wikidata |
Un antibiótico (del griego antiguo αντιβιοτικά, antibiotiká ), también llamado antibacteriano , es un tipo de fármaco antimicrobiano utilizado en el tratamiento y prevención de infecciones bacterianas. Pueden matar o inhibir el crecimiento de bacterias. Un número limitado de antibióticos también posee actividad antiprotozoaria. Los antibióticos no son efectivos contra virus como el resfriado común o la influenza; los medicamentos que inhiben los virus se denominan medicamentos antivirales o antivirales en lugar de antibióticos.
A veces, el término antibiótico (que significa "vida opuesta") se utiliza para referirse a cualquier sustancia utilizada contra los microbios. Sin embargo, la diferencia entre antibióticos (es decir, penicilina) y antimicrobianos (es decir, sulfonamida) es que el primero se produce naturalmente, mientras que el último es sintético (aunque ambos mantienen el mismo objetivo de matar o prevenir el crecimiento de microorganismos). Algunas fuentes distinguen entre antibacteriano y antibiótico; los antibacterianos se usan en jabones y desinfectantes, mientras que los antibióticos se usan como medicamentos.
Los antibióticos revolucionaron la medicina en el siglo XX. Sin embargo, su efectividad y fácil acceso también han llevado a su uso excesivo, provocando que las bacterias desarrollen resistencia. Esto ha provocado problemas generalizados, tanto como para incitar a la Organización Mundial de la Salud a clasificar la resistencia a los antimicrobianos como una "seria amenaza [que] ya no es una predicción para el futuro, está sucediendo ahora en todas las regiones del mundo y tiene el potencial de afectar a cualquier persona, de cualquier edad, en cualquier país ".
Usos médicos
Los antibióticos se usan para tratar o prevenir infecciones bacterianas y, a veces, infecciones por protozoos. (El metronidazol es efectivo contra varias enfermedades parasitarias). Cuando se sospecha que una infección es responsable de una enfermedad pero el patógeno responsable no ha sido identificado, se adopta una terapia empírica. Esto implica la administración de un antibiótico de amplio espectro en función de los signos y síntomas presentados y se inicia a la espera de resultados de laboratorio que pueden llevar varios días.
Cuando el microorganismo patógeno responsable ya se conoce o ha sido identificado, se puede iniciar la terapia definitiva. Esto generalmente implicará el uso de un antibiótico de espectro estrecho. La elección del antibiótico administrado también se basará en su costo. La identificación es críticamente importante ya que puede reducir el costo y la toxicidad de la terapia con antibióticos y también reducir la posibilidad de aparición de resistencia a los antimicrobianos. Para evitar la cirugía, se pueden administrar antibióticos para la apendicitis aguda no complicada.
Se pueden administrar antibióticos como medida preventiva y esto generalmente se limita a poblaciones en riesgo, como aquellas con un sistema inmune debilitado (particularmente en casos de VIH para prevenir la neumonía), las personas que toman medicamentos inmunosupresores, los pacientes con cáncer y los que se someten a cirugía. Su uso en procedimientos quirúrgicos es ayudar a prevenir la infección de incisiones. Tienen un papel importante en la profilaxis antibiótica dental donde su uso puede prevenir la bacteriemia y la consiguiente endocarditis infecciosa. Los antibióticos también se usan para prevenir la infección en casos de neutropenia particularmente relacionada con el cáncer.
Administración
Hay muchas rutas de administración diferentes para el tratamiento con antibióticos. Los antibióticos generalmente se toman por vía oral. En casos más severos, particularmente infecciones sistémicas profundas, los antibióticos pueden administrarse por vía intravenosa o por inyección. Cuando el sitio de infección es de fácil acceso, se pueden administrar antibióticos tópicamente en forma de gotas oculares en la conjuntiva para conjuntivitis o gotas para los oídos para infecciones de oído y casos agudos de oído de nadador. El uso tópico es también una de las opciones de tratamiento para algunas afecciones de la piel, como el acné y la celulitis. Las ventajas de la aplicación tópica incluyen lograr una concentración alta y sostenida de antibiótico en el sitio de la infección; reduciendo el potencial de absorción sistémica y toxicidad, y se reducen los volúmenes totales de antibióticos necesarios, lo que también reduce el riesgo de uso indebido de antibióticos. Se ha informado que los antibióticos tópicos aplicados sobre ciertos tipos de heridas quirúrgicas reducen el riesgo de infecciones del sitio quirúrgico. Sin embargo, hay ciertas causas generales de preocupación con la administración tópica de antibióticos. Puede ocurrir algo de absorción sistémica del antibiótico; la cantidad de antibiótico aplicado es difícil de dosificar con precisión, y también existe la posibilidad de que se produzcan reacciones de hipersensibilidad local o dermatitis de contacto.
Efectos secundarios
Los antibióticos se examinan para detectar cualquier efecto negativo antes de su aprobación para uso clínico, y generalmente se consideran seguros y bien tolerados. Sin embargo, algunos antibióticos se han asociado con una gran cantidad de efectos secundarios adversos que varían de leves a muy graves dependiendo del tipo de antibiótico utilizado, los microbios seleccionados y el paciente individual. Los efectos secundarios pueden reflejar las propiedades farmacológicas o toxicológicas del antibiótico o pueden implicar hipersensibilidad o reacciones alérgicas. Los efectos adversos van desde fiebre y náuseas hasta reacciones alérgicas importantes, que incluyen fotodermatitis y anafilaxia. Los perfiles de seguridad de los medicamentos más nuevos a menudo no están tan bien establecidos como para aquellos que tienen un largo historial de uso.
Los efectos secundarios comunes incluyen diarrea, que resulta de la alteración de la composición de la especie en la flora intestinal, que resulta, por ejemplo, en el crecimiento excesivo de bacterias patógenas, como Clostridium difficile . Los antibacterianos también pueden afectar la flora vaginal y pueden conducir al crecimiento excesivo de especies de levadura del género Candida en el área vulvovaginal. Los efectos secundarios adicionales pueden ser el resultado de la interacción con otras drogas, como la posibilidad de un daño muscular debido a la administración de un antibiótico de quinolona con un corticosteroide sistémico.
Correlación con la obesidad
La exposición a antibióticos en las primeras etapas de la vida se asocia con una mayor masa corporal en humanos y modelos de ratones. La vida temprana es un período crítico para el establecimiento de la microbiota intestinal y para el desarrollo metabólico. Los ratones expuestos a tratamiento antibiótico subterapéutico (STAT), con penicilina, vancomicina o clortetraciclina, tenían una composición alterada de la microbiota intestinal y sus capacidades metabólicas. Un estudio informó que los ratones que recibieron penicilina en dosis bajas (1 μg / g de peso corporal) al nacer y durante el proceso de destete tenían un aumento de masa corporal y de masa grasa, crecimiento acelerado y expresión hepática aumentada de genes implicados en la adipogénesis, en comparación con ratones de control. Además, la penicilina en combinación con una dieta alta en grasas aumentó los niveles de insulina en ayunas en ratones. Sin embargo, no está claro si los antibióticos causan obesidad en humanos. Los estudios han encontrado una correlación entre la exposición temprana de los antibióticos (<6 meses) y el aumento de la masa corporal (a los 10 y 20 meses). Otro estudio encontró que el tipo de exposición a los antibióticos también fue significativo, con el mayor riesgo de sobrepeso en aquellos que recibieron macrólidos en comparación con la penicilina y la cefalosporina. Por lo tanto, existe una correlación entre la exposición a antibióticos en los primeros años de vida y la obesidad en los humanos, pero no está claro si existe o no una relación causal. Aunque existe una correlación entre el uso de antibióticos en los primeros años de vida y la obesidad, el efecto de los antibióticos en la obesidad en los seres humanos debe sopesarse frente a los efectos beneficiosos del tratamiento clínicamente indicado con antibióticos en la infancia. Los estudios han encontrado una correlación entre la exposición temprana de los antibióticos (<6 meses) y el aumento de la masa corporal (a los 10 y 20 meses). Otro estudio encontró que el tipo de exposición a los antibióticos también fue significativo, con el mayor riesgo de sobrepeso en aquellos que recibieron macrólidos en comparación con la penicilina y la cefalosporina. Por lo tanto, existe una correlación entre la exposición a antibióticos en los primeros años de vida y la obesidad en los humanos, pero no está claro si existe o no una relación causal. Aunque existe una correlación entre el uso de antibióticos en los primeros años de vida y la obesidad, el efecto de los antibióticos en la obesidad en los seres humanos debe sopesarse frente a los efectos beneficiosos del tratamiento clínicamente indicado con antibióticos en la infancia. Los estudios han encontrado una correlación entre la exposición temprana de los antibióticos (<6 meses) y el aumento de la masa corporal (a los 10 y 20 meses). Otro estudio encontró que el tipo de exposición a los antibióticos también fue significativo, con el mayor riesgo de sobrepeso en aquellos que recibieron macrólidos en comparación con la penicilina y la cefalosporina. Por lo tanto, existe una correlación entre la exposición a antibióticos en los primeros años de vida y la obesidad en los humanos, pero no está claro si existe o no una relación causal. Aunque existe una correlación entre el uso de antibióticos en los primeros años de vida y la obesidad, el efecto de los antibióticos en la obesidad en los seres humanos debe sopesarse frente a los efectos beneficiosos del tratamiento clínicamente indicado con antibióticos en la infancia. Otro estudio encontró que el tipo de exposición a los antibióticos también fue significativo, con el mayor riesgo de sobrepeso en aquellos que recibieron macrólidos en comparación con la penicilina y la cefalosporina. Por lo tanto, existe una correlación entre la exposición a antibióticos en los primeros años de vida y la obesidad en los humanos, pero no está claro si existe o no una relación causal. Aunque existe una correlación entre el uso de antibióticos en los primeros años de vida y la obesidad, el efecto de los antibióticos en la obesidad en los seres humanos debe sopesarse frente a los efectos beneficiosos del tratamiento clínicamente indicado con antibióticos en la infancia. Otro estudio encontró que el tipo de exposición a los antibióticos también fue significativo, con el mayor riesgo de sobrepeso en aquellos que recibieron macrólidos en comparación con la penicilina y la cefalosporina. Por lo tanto, existe una correlación entre la exposición a antibióticos en los primeros años de vida y la obesidad en los humanos, pero no está claro si existe o no una relación causal. Aunque existe una correlación entre el uso de antibióticos en los primeros años de vida y la obesidad, el efecto de los antibióticos en la obesidad en los seres humanos debe sopesarse frente a los efectos beneficiosos del tratamiento clínicamente indicado con antibióticos en la infancia. pero no está claro si existe o no una relación causal. Aunque existe una correlación entre el uso de antibióticos en los primeros años de vida y la obesidad, el efecto de los antibióticos en la obesidad en los seres humanos debe sopesarse frente a los efectos beneficiosos del tratamiento clínicamente indicado con antibióticos en la infancia. pero no está claro si existe o no una relación causal. Aunque existe una correlación entre el uso de antibióticos en los primeros años de vida y la obesidad, el efecto de los antibióticos en la obesidad en los seres humanos debe sopesarse frente a los efectos beneficiosos del tratamiento clínicamente indicado con antibióticos en la infancia.
Interacciones
Pastillas anticonceptivas
Existen pocos estudios bien controlados sobre si el uso de antibióticos aumenta el riesgo de fracaso del anticonceptivo oral. La mayoría de los estudios indican que los antibióticos no interfieren con las píldoras anticonceptivas, como los estudios clínicos que sugieren que la tasa de fracaso de las píldoras anticonceptivas causadas por antibióticos es muy baja (alrededor del 1%). Las situaciones que pueden aumentar el riesgo de fracaso del anticonceptivo oral incluyen el incumplimiento (falta de tomar la píldora), vómitos o diarrea. Trastornos gastrointestinales o variabilidad interpaciente en la absorción anticonceptiva oral que afecta los niveles de etinilestradiol en la sangre. Las mujeres con irregularidades menstruales pueden tener un mayor riesgo de fracaso y se les debe recomendar el uso de anticoncepción de respaldo durante el tratamiento con antibióticos y durante una semana después de su finalización.
En los casos en que se ha sugerido que los antibióticos afectan la eficacia de las píldoras anticonceptivas, como el antibiótico de amplio espectro rifampicina, estos casos pueden deberse a un aumento en las actividades de las enzimas hepáticas hepáticas que causan una mayor descomposición de los ingredientes activos de la píldora . También se han sugerido efectos en la flora intestinal, que podrían resultar en una reducción de la absorción de estrógenos en el colon, pero tales sugerencias no han sido concluyentes y controvertidas. Los médicos recomiendan que se apliquen medidas anticonceptivas adicionales durante las terapias que usan antibióticos que se sospecha que interactúan con los anticonceptivos orales.
Alcohol
Las interacciones entre el alcohol y ciertos antibióticos pueden ocurrir y pueden causar efectos secundarios y una disminución de la efectividad del tratamiento con antibióticos. Si bien es poco probable que el consumo moderado de alcohol interfiera con muchos antibióticos comunes, existen tipos específicos de antibióticos, con los cuales el consumo de alcohol puede causar efectos secundarios graves. Por lo tanto, los riesgos potenciales de los efectos secundarios y la eficacia dependen del tipo de antibiótico administrado.
Los antibióticos como metronidazol, tinidazol, cefamandol, latamoxef, cefoperazona, cefmenoxima y furazolidona causan una reacción química similar al disulfiram con el alcohol al inhibir su degradación por la acetaldehído deshidrogenasa, lo que puede provocar vómitos, náuseas y dificultad para respirar. Además, la eficacia de la doxiciclina y el succinato de eritromicina puede verse reducida por el consumo de alcohol. Otros efectos del alcohol sobre la actividad de los antibióticos incluyen actividad alterada de las enzimas hepáticas que descomponen el compuesto antibiótico. Sin embargo, el vino tinto con un alto grado de polifenoles demuestra propiedades antibacterianas in-vitro.
Farmacodinámica
El resultado exitoso de la terapia antimicrobiana con compuestos antibacterianos depende de varios factores. Estos incluyen mecanismos de defensa del huésped, la ubicación de la infección y las propiedades farmacocinéticas y farmacodinámicas del antibacteriano. Una actividad bactericida de antibacterianos puede depender de la fase de crecimiento bacteriano, y a menudo requiere una actividad metabólica continua y la división de las células bacterianas. Estos hallazgos se basan en estudios de laboratorio y en entornos clínicos también se ha demostrado que eliminan la infección bacteriana. Dado que la actividad de los antibacterianos depende frecuentemente de su concentración, in vitro la caracterización de la actividad antibacteriana comúnmente incluye la determinación de la concentración mínima inhibitoria y la concentración bactericida mínima de un antibacteriano. Para predecir el resultado clínico, la actividad antimicrobiana de un antibacteriano generalmente se combina con su perfil farmacocinético, y se usan varios parámetros farmacológicos como marcadores de la eficacia del fármaco.
Terapia de combinación
En importantes enfermedades infecciosas, incluida la tuberculosis, la terapia de combinación (es decir, la aplicación concurrente de dos o más antibióticos) se ha utilizado para retrasar o prevenir la aparición de resistencia. En las infecciones bacterianas agudas, se prescriben antibióticos como parte de la terapia de combinación por sus efectos sinérgicos para mejorar los resultados del tratamiento ya que el efecto combinado de ambos antibióticos es mejor que su efecto individual. Las infecciones por Staphylococcus aureus resistentes a meticilina pueden tratarse con una terapia combinada de ácido fusídico y rifampicina.Los antibióticos utilizados en combinación también pueden ser antagónicos y los efectos combinados de los dos antibióticos pueden ser menores que si el antibiótico individual se administrara como parte de una monoterapia . Por ejemplo, el cloranfenicol y las tetraciclinas son antagonistas de las penicilinas y los aminoglucósidos. Sin embargo, esto puede variar dependiendo de la especie de bacteria. En general, las combinaciones de un antibiótico bacteriostático y un antibiótico bactericida son antagónicas.
Clases
Los antibióticos comúnmente se clasifican según su mecanismo de acción, estructura química o espectro de actividad. La mayoría de las funciones bacterianas objetivo o procesos de crecimiento. Aquellos que se dirigen a la pared celular bacteriana (penicilinas y cefalosporinas) o la membrana celular (polimixinas) o interfieren con las enzimas bacterianas esenciales (rifamicinas, lipiarmicinas, quinolonas y sulfonamidas) tienen actividades bactericidas. Los inhibidores de la síntesis de proteínas (macrólidos, lincosamidas y tetraciclinas) suelen ser bacteriostáticos (con la excepción de los aminoglucósidos bactericidas). La categorización adicional se basa en su especificidad objetivo. Los antibióticos de "espectro estrecho" se dirigen a tipos específicos de bacterias, como gramnegativos o grampositivos, mientras que los antibióticos de amplio espectro afectan a un amplio rango de bacterias.
Producción
Con los avances en la química médica, la mayoría de los antibacterianos modernos son modificaciones semisintéticas de diversos compuestos naturales. Estos incluyen, por ejemplo, los antibióticos beta-lactámicos, que incluyen las penicilinas (producidas por hongos del género Penicillium ), las cefalosporinas y los carbapenems. Los compuestos que aún están aislados de organismos vivos son los aminoglucósidos, mientras que otros antibacterianos, por ejemplo, las sulfonamidas, las quinolonas y las oxazolidinonas, se producen únicamente por síntesis química. Muchos compuestos antibacterianos son moléculas relativamente pequeñas con un peso molecular de menos de 1000 daltons.
Desde los primeros esfuerzos pioneros de Howard Florey and Chain en 1939, la importancia de los antibióticos, incluidos los antibacterianos, para la medicina ha llevado a intensas investigaciones para producir antibacterianos a gran escala. Tras el cribado de antibacterianos contra una amplia gama de bacterias, la producción de los compuestos activos se lleva a cabo mediante fermentación, habitualmente en condiciones fuertemente aeróbicas.
Resistencia
La aparición de resistencia de las bacterias a los antibióticos es un fenómeno común. El surgimiento de la resistencia a menudo refleja los procesos evolutivos que tienen lugar durante la terapia con antibióticos. El tratamiento con antibióticos puede seleccionar cepas bacterianas con capacidad mejorada fisiológica o genéticamente para sobrevivir a altas dosis de antibióticos. Bajo ciertas condiciones, puede resultar en un crecimiento preferencial de bacterias resistentes, mientras que el crecimiento de bacterias susceptibles es inhibido por la droga. Por ejemplo, la selección antibacteriana para cepas que tenían genes de resistencia antibacteriana previamente adquiridos se demostró en 1943 por el experimento de Luria-Delbrück. Los antibióticos como la penicilina y la eritromicina, que solían tener una alta eficacia contra muchas especies y cepas bacterianas, se han vuelto menos efectivos,
La resistencia puede tomar la forma de una degradación biológica de los productos farmacéuticos, como las bacterias del suelo que degradan la sulfametazina, introducidas en la sulfametazina a través de las heces de cerdo medicadas. La supervivencia de las bacterias a menudo resulta de una resistencia heredable, pero el crecimiento de la resistencia a los antibacterianos también se produce a través de la transferencia horizontal de genes. La transferencia horizontal es más probable que suceda en lugares de uso frecuente de antibióticos.
La resistencia antibacteriana puede imponer un costo biológico, lo que reduce la aptitud de las cepas resistentes, lo que puede limitar la propagación de bacterias resistentes a los antibacterianos, por ejemplo, en ausencia de compuestos antibacterianos. Mutaciones adicionales, sin embargo, pueden compensar este costo de aptitud y pueden ayudar a la supervivencia de estas bacterias.
Los datos paleontológicos muestran que tanto los antibióticos como la resistencia a los antibióticos son compuestos y mecanismos antiguos. Los objetivos antibióticos útiles son aquellos para los cuales las mutaciones tienen un impacto negativo en la reproducción o viabilidad bacteriana.
Existen varios mecanismos moleculares de resistencia antibacteriana. La resistencia antibacteriana intrínseca puede ser parte de la composición genética de las cepas bacterianas. Por ejemplo, un objetivo antibiótico puede estar ausente del genoma bacteriano. La resistencia adquirida es el resultado de una mutación en el cromosoma bacteriano o la adquisición de ADN extracromosómico. Las bacterias productoras de antibacterianos han desarrollado mecanismos de resistencia que se ha demostrado que son similares a, y pueden haber sido transferidos a, cepas resistentes a los antibacterianos. La diseminación de la resistencia antibacteriana a menudo se produce por transmisión vertical de mutaciones durante el crecimiento y por recombinación genética del ADN mediante intercambio genético horizontal. Por ejemplo, los genes de resistencia antibacteriana se pueden intercambiar entre diferentes cepas bacterianas o especies a través de plásmidos que llevan estos genes de resistencia. Los plásmidos que portan varios genes de resistencia diferentes pueden conferir resistencia a múltiples antibacterianos. La resistencia cruzada a varios antibacterianos también puede ocurrir cuando un mecanismo de resistencia codificado por un solo gen transmite resistencia a más de un compuesto antibacteriano.
Las cepas y especies resistentes a los antibacterianos, a veces denominadas "superbacterias", ahora contribuyen a la aparición de enfermedades que durante un tiempo estuvieron bien controladas. Por ejemplo, las cepas bacterianas emergentes que causan tuberculosis que son resistentes a tratamientos antibacterianos previamente efectivos presentan muchos desafíos terapéuticos. Cada año, se estima que en todo el mundo se producen cerca de medio millón de casos nuevos de tuberculosis resistente a múltiples fármacos (MDR-TB). Por ejemplo, NDM-1 es una enzima recientemente identificada que transmite resistencia bacteriana a una amplia gama de antibacterianos betalactámicos. La Agencia de Protección de la Salud del Reino Unido ha declarado que "la mayoría de los aislados con enzima NDM-1 son resistentes a todos los antibióticos intravenosos estándar para el tratamiento de infecciones graves". El 26 de mayo de 2016 una bacteria E coli "superbacteria"
Mal uso
Por el Libro de UCI "La primera regla de los antibióticos es tratar de no usarlos, y la segunda regla es tratar de no usar demasiados". El tratamiento inadecuado con antibióticos y el uso excesivo de antibióticos han contribuido a la aparición de bacterias resistentes a los antibióticos. La prescripción de antibióticos es un ejemplo de uso indebido. Muchos antibióticos se recetan con frecuencia para tratar síntomas o enfermedades que no responden a los antibióticos o que probablemente se resuelvan sin tratamiento. Además, se recetan antibióticos incorrectos o subóptimos para ciertas infecciones bacterianas. El uso excesivo de antibióticos, como la penicilina y la eritromicina, se ha asociado con la aparición de resistencia a los antibióticos desde la década de 1950.
Las formas comunes de uso indebido de antibióticos incluyen el uso excesivo de antibióticos profilácticos en viajeros y la incapacidad de los profesionales médicos para prescribir la dosis correcta de antibióticos sobre la base del peso del paciente y el historial de uso anterior. Otras formas de uso indebido incluyen la omisión de tomar todo el curso prescrito del antibiótico, la administración y la dosificación incorrecta o la falta de reposo para una recuperación suficiente. El tratamiento antibiótico inapropiado, por ejemplo, es su receta para tratar infecciones virales como el resfriado común. Un estudio sobre infecciones del tracto respiratorio reveló que "era más probable que los médicos recetasen antibióticos a pacientes que parecían esperarlos". Las intervenciones multifactoriales dirigidas tanto a médicos como a pacientes pueden reducir la prescripción inadecuada de antibióticos.
Varias organizaciones preocupadas por la resistencia a los antimicrobianos están presionando para eliminar el uso innecesario de antibióticos. Los problemas de uso indebido y uso excesivo de antibióticos han sido abordados por la formación de la Fuerza de Tarea Interinstitucional de los EE. UU. Sobre la resistencia a los antimicrobianos. Este grupo de trabajo tiene como objetivo abordar activamente la resistencia a los antimicrobianos y está coordinado por los Centros para el Control y la Prevención de Enfermedades de EE. UU., La Administración de Alimentos y Fármacos (FDA) y los Institutos Nacionales de Salud (NIH), así como otras agencias de EE. UU. Un grupo de campaña de ONG es Keep Antibiotics Working . En Francia, una campaña gubernamental "Antibióticos no son automáticos" comenzó en 2002 y condujo a una marcada reducción de prescripciones innecesarias de antibióticos, especialmente en niños.
La aparición de resistencia a los antibióticos ha provocado restricciones en su uso en el Reino Unido en 1970 (informe Swann 1969), y la UE ha prohibido el uso de antibióticos como agentes de promoción del crecimiento desde 2003. Además, varias organizaciones (incluida la Organización Mundial de la Salud, la Academia Nacional de Ciencias y la Administración de Alimentos y Medicamentos de los EE. UU.) han abogado por restringir la cantidad de uso de antibióticos en la producción de alimentos para animales. Sin embargo, comúnmente hay retrasos en las acciones regulatorias y legislativas para limitar el uso de antibióticos, atribuibles en parte a la resistencia contra tal regulación por industrias que usan o venden antibióticos, y al tiempo requerido para la investigación para probar vínculos causales entre su uso y resistencia a ellos . Dos proyectos de ley federales (S.742 y HR 2562) con el objetivo de eliminar el uso no terapéutico de antibióticos en animales de alimento de los EE. UU. Se propusieron, pero no se aprobaron. Estos proyectos de ley fueron respaldados por organizaciones médicas y de salud pública, incluidas la Asociación Americana de Enfermeras Holísticas, la Asociación Médica Estadounidense y la Asociación Estadounidense de Salud Pública (APHA).
A pesar de las promesas de las compañías de alimentos y restaurantes de reducir o eliminar la carne que proviene de animales tratados con antibióticos, la compra de antibióticos para su uso en animales de granja ha aumentado cada año.
Ha habido un uso extenso de antibióticos en la cría de animales. En los Estados Unidos, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) planteó la cuestión del surgimiento de cepas bacterianas resistentes a los antibióticos debido al uso de antibióticos en el ganado en 1977. En marzo de 2012, el Tribunal de Distrito de los Estados Unidos para el Distrito Sur de Nueva York, al dictaminar sobre una acción presentada por el Consejo de Defensa de los Recursos Naturales y otros, ordenó a la FDA revocar las aprobaciones para el uso de antibióticos en el ganado, lo que viola las regulaciones de la FDA.
Historia
Antes de principios del siglo XX, los tratamientos para las infecciones se basaban principalmente en el folclore medicinal. Las mezclas con propiedades antimicrobianas que se usaron en tratamientos de infecciones se describieron hace más de 2000 años. Muchas culturas antiguas, incluidos los antiguos egipcios y los antiguos griegos, utilizaron materiales y extractos de moho y plantas especialmente seleccionados para tratar infecciones.
El uso de antibióticos en la medicina moderna comenzó con el descubrimiento de antibióticos sintéticos derivados de colorantes.
Antibióticos sintéticos derivados de colorantes
La quimioterapia con antibióticos sintéticos como una ciencia y el desarrollo de antibacterianos comenzó en Alemania con Paul Ehrlich a fines de la década de 1880. Ehrlich notó que ciertos colorantes teñirían células humanas, animales o bacterianas, mientras que otros no. Luego propuso la idea de que sería posible crear sustancias químicas que actuarían como una droga selectiva que se uniría y mataría las bacterias sin dañar al huésped humano. Después de examinar cientos de tintes contra varios organismos, en 1907, descubrió un medicamento medicinalmente útil, el primer salvarsan antibacteriano sintético ahora llamado arsfenamina.
La era del tratamiento antibacteriano comenzó con los descubrimientos de antibióticos sintéticos derivados del arsénico por Alfred Bertheim y Ehrlich en 1907. Ehrlich y Bertheim experimentaron con varios productos químicos derivados de colorantes para tratar la tripanosomiasis en ratones y la infección por espiroquetos en conejos. Mientras que sus primeros compuestos eran demasiado tóxicos, Ehrlich y Sahachiro Hata, un bacteriólogo japonés que trabajaba con Erlich en la búsqueda de un medicamento para tratar la sífilis, lograron el éxito con el compuesto 606 en su serie de experimentos. En 1910, Ehrlich y Hata anunciaron su descubrimiento, al que llamaron droga "606", en el Congreso de Medicina Interna en Wiesbaden. La compañía Hoechst comenzó a comercializar el compuesto a fines de 1910 bajo el nombre de Salvarsan. Esta droga ahora se conoce como arsfenamina. El medicamento se usó para tratar la sífilis en la primera mitad del siglo XX. En 1908, Ehrlich recibió el Premio Nobel de Fisiología o Medicina por sus contribuciones a la inmunología. Hata fue nominado para el Premio Nobel de Química en 1911 y para el Premio Nobel de Fisiología o Medicina en 1912 y 1913.
La primera sulfonamida y la primera droga antibacteriana sistémicamente activa, Prontosil, fue desarrollada por un equipo de investigación dirigido por Gerhard Domagk en 1932 o 1933 en los Laboratorios Bayer del conglomerado IG Farben en Alemania, por la cual Domagk recibió el Premio Nobel de Fisiología en 1939 o Medicina. La sulfanilamida, el fármaco activo de Prontosil, no era patentable, ya que se había utilizado en la industria del tinte durante algunos años. Prontosil tuvo un efecto relativamente amplio contra los cocos Gram-positivos, pero no contra las enterobacterias. La investigación fue estimulada rápidamente por su éxito. El descubrimiento y desarrollo de este medicamento con sulfonamida abrió la era de los antibacterianos.
Penicilina y otros antibióticos naturales
Las observaciones sobre el crecimiento de algunos microorganismos que inhiben el crecimiento de otros microorganismos se han reportado desde fines del siglo XIX. Estas observaciones de antibiosis entre microorganismos condujeron al descubrimiento de antibacterianos naturales. Louis Pasteur observó, "si pudiéramos intervenir en el antagonismo observado entre algunas bacterias, ofrecería quizás las mayores esperanzas para la terapéutica".
En 1874, el médico Sir William Roberts señaló que las culturas del moho Penicillium glaucum que se usa en la fabricación de algunos tipos de queso azul no mostraban contaminación bacteriana. En 1876, el físico John Tyndall también contribuyó a este campo. Pasteur realizó una investigación que muestra que Bacillus anthracis no crecería en presencia del molde relacionado Penicillium notatum .
En 1895 Vincenzo Tiberio, médico italiano, publicó un documento sobre el poder antibacteriano de algunos extractos de moho.
En 1897, el estudiante de doctorado Ernest Duchesne presentó una disertación, "Contribución al estudio de la concurrencia vital entre los micro-organismos: antagonismo entre las enfermedades y los microbios" (Contribución al estudio de la competencia vital en los microorganismos: antagonismo entre moldes y microbios), el primer trabajo académico conocido para considerar las capacidades terapéuticas de los moldes resultantes de su actividad antimicrobiana. En su tesis, Duchesne propuso que las bacterias y los mohos participan en una batalla perpetua por la supervivencia. Duchesne observó que E. coli fue eliminada por Penicillium glaucum cuando ambos crecieron en el mismo cultivo. También observó que cuando inoculaba animales de laboratorio con dosis letales de bacilos tifoideos junto con Penicillium glaucum, los animales no contrajeron tifus. Lamentablemente, el servicio militar de Duchesne después de obtener su título le impidió realizar más investigaciones. Duchesne murió de tuberculosis, una enfermedad ahora tratada con antibióticos.
En 1928, Sir Alexander Fleming postuló la existencia de la penicilina, una molécula producida por ciertos moldes que mata o detiene el crecimiento de ciertos tipos de bacterias. Fleming estaba trabajando en un cultivo de bacterias causantes de enfermedades cuando notó las esporas de un moho verde, Penicillium chrysogenum, en una de sus placas de cultivo. Observó que la presencia del molde mató o evitó el crecimiento de la bacteria. Fleming postuló que el molde debe secretar una sustancia antibacteriana, a la que llamó penicilina en 1928. Fleming creía que sus propiedades antibacterianas podrían explotarse para la quimioterapia. Inicialmente caracterizó algunas de sus propiedades biológicas e intentó usar una preparación cruda para tratar algunas infecciones, pero no pudo continuar su desarrollo sin la ayuda de químicos entrenados.
Ernst Chain, Howard Florey y Edward Abraham tuvieron éxito en la purificación de la primera penicilina, la penicilina G, en 1942, pero no fue ampliamente disponible fuera del ejército aliado antes de 1945. Más tarde, Norman Heatley desarrolló la técnica de extracción posterior para la purificación eficiente de la penicilina a granel . La estructura química de la penicilina fue propuesta por primera vez por Abraham en 1942 y luego confirmada por Dorothy Crowfoot Hodgkin en 1945. La penicilina purificada mostraba una potente actividad antibacteriana contra un amplio rango de bacterias y tenía baja toxicidad en humanos. Además, su actividad no fue inhibida por componentes biológicos tales como pus, a diferencia de las sulfonamidas sintéticas. (ver más abajo) El desarrollo de la penicilina provocó un renovado interés en la búsqueda de compuestos antibióticos con eficacia y seguridad similares.
Florey atribuyó a René Dubos el haber sido pionero en el abordaje de la búsqueda deliberada y sistemática de compuestos antibacterianos, lo que condujo al descubrimiento de la gramicidina y revivió la investigación de Florey sobre la penicilina. En 1939, coincidiendo con el comienzo de la Segunda Guerra Mundial, Dubos había informado sobre el descubrimiento del primer antibiótico derivado de la naturaleza, la tirotricina, un compuesto de 20% de gramicidina y 80% de tirosidina, de B. brevis. Fue uno de los primeros antibióticos comercialmente fabricados y fue muy eficaz en el tratamiento de heridas y úlceras durante la Segunda Guerra Mundial. La gramicidina, sin embargo, no pudo usarse sistémicamente debido a la toxicidad. La tirocidina también demostró ser demasiado tóxica para el uso sistémico. Los resultados de la investigación obtenidos durante ese período no se compartieron entre el Eje y las potencias aliadas durante la Segunda Guerra Mundial y el acceso limitado durante la Guerra Fría.
Etimología
El término "antibiosis", que significa "contra la vida", fue introducido por el bacteriólogo francés Jean Paul Vuillemin como un nombre descriptivo del fenómeno exhibido por estas primeras drogas antibacterianas. La antibiosis se describió por primera vez en 1877 en bacterias cuando Louis Pasteur y Robert Koch observaron que un bacilo en el aire podría inhibir el crecimiento de Bacillus anthracis . Estas drogas fueron luego renombradas como antibióticas por Selman Waksman, un microbiólogo estadounidense, en 1942.
El término antibiótico fue utilizado por primera vez en 1942 por Selman Waksman y sus colaboradores en artículos de revistas para describir cualquier sustancia producida por un microorganismo que sea antagónica al crecimiento de otros microorganismos en alta dilución. Esta definición excluye las sustancias que matan las bacterias pero que no son producidas por microorganismos (como los jugos gástricos y el peróxido de hidrógeno). También excluyó compuestos antibacterianos sintéticos como las sulfonamidas. En el uso actual, el término "antibiótico" se aplica a cualquier medicamento que mata las bacterias o inhibe su crecimiento, independientemente de si ese medicamento es producido por un microorganismo o no.
El término "antibiótico" deriva de anti + βιωτικός ( biōtikos ), "apto para la vida, animado", que proviene de βίωσις ( biōsis ), "forma de vida", y de βίος ( bios ), "vida". El término "antibacteriano" deriva del griego ἀντί ( anti ), "contra" + βακτήριον ( baktērion ), diminutivo de βακτηρία ( baktēria ), "bastón", porque las primeras bacterias que se descubrieron tenían forma de vara.
Investigación
Alternativas
El aumento en las cepas bacterianas que son resistentes a las terapias antibacterianas convencionales, junto con la disminución del número de nuevos antibióticos que se están desarrollando en la actualidad, ha impulsado el desarrollo de estrategias de tratamiento de enfermedades bacterianas que son alternativas a los antibacterianos convencionales. Los enfoques no compuestos (es decir, productos distintos de los agentes antibacterianos clásicos) que se dirigen a las bacterias o los enfoques que se dirigen al huésped, incluyendo la terapia con fagos y las vacunas, también se están investigando para combatir el problema.
Agentes modificadores de la resistencia
Una estrategia para abordar la resistencia a los medicamentos bacterianos es el descubrimiento y la aplicación de compuestos que modifican la resistencia a los antibacterianos comunes. Los agentes modificadores de la resistencia son capaces de suprimir parcial o completamente los mecanismos de resistencia bacteriana. Por ejemplo, algunos agentes modificadores de la resistencia pueden inhibir los mecanismos de resistencia a múltiples fármacos, tales como el flujo de salida del fármaco desde la célula, aumentando así la susceptibilidad de las bacterias a un antibacteriano. Los objetivos incluyen:
- El inhibidor de eflujo Phe-Arg-β-naftilamida.
- Inhibidores de beta-lactamasa, como ácido clavulánico y sulbactam
Los estímulos metabólicos como el azúcar pueden ayudar a erradicar un cierto tipo de bacteria tolerante a los antibióticos al mantener su metabolismo activo.
Vacunas
Las vacunas se basan en la modulación inmune o el aumento. La vacunación excita o refuerza la competencia inmune de un huésped para evitar la infección, lo que lleva a la activación de los macrófagos, la producción de anticuerpos, la inflamación y otras reacciones inmunes clásicas. Las vacunas antibacterianas han sido responsables de una reducción drástica de las enfermedades bacterianas globales. Las vacunas elaboradas a partir de células enteras atenuadas o lisados se han reemplazado en gran parte por vacunas menos reactogénicas, libres de células, que consisten en componentes purificados, incluidos polisacáridos capsulares y sus conjugados, en portadores de proteínas, así como toxinas inactivadas (toxoides) y proteínas.
Terapia de fagos
La terapia de fagos es otro método para tratar cepas de bacterias resistentes a los antibióticos. La terapia de fagos infecta bacterias patógenas con sus propios virus. Los bacteriófagos y sus rangos de hospederos son extremadamente específicos para ciertas bacterias, por lo que no perturban el organismo anfitrión y la microflora intestinal a diferencia de los antibióticos. Los bacteriófagos, también conocidos simplemente como fagos, infectan y pueden matar bacterias y afectar el crecimiento bacteriano principalmente durante los ciclos líticos. Los fagos insertan su ADN en la bacteria, donde se transcribe y se utiliza para fabricar nuevos fagos, después de lo cual la célula se lisará, liberando un nuevo fago capaz de infectar y destruir otras bacterias de la misma cepa. La alta especificidad del fago protege el "bien" bacterias de la destrucción. Sin embargo, también existen algunas desventajas con el uso de bacteriófagos. Los bacteriófagos pueden albergar factores de virulencia o genes tóxicos en sus genomas y la identificación de genes con similitud con factores de virulencia o toxinas conocidos mediante secuenciación genómica puede ser prudente antes de su uso. Además, la administración oral y IV de fagos para la erradicación de infecciones bacterianas presenta un riesgo de seguridad mucho más alto que la aplicación tópica, y existe la preocupación adicional de la respuesta inmune incierta a estos grandes cócteles antigénicos. Existen importantes obstáculos regulatorios que deben aclararse para tales terapias. El uso de bacteriófagos como reemplazo de los agentes antimicrobianos contra los patógenos MDR ya no responde a los antibióticos convencionales sigue siendo una opción atractiva a pesar de numerosos desafíos.
Fitoquímicos
Las plantas son una fuente importante de compuestos antimicrobianos y los curanderos tradicionales han utilizado durante mucho tiempo las plantas para prevenir o curar enfermedades infecciosas. Recientemente se ha renovado el interés en el uso de productos naturales para la identificación de nuevos miembros del "antibiótico-ome" (definido como productos naturales con actividad antibiótica) y su aplicación en el descubrimiento de fármacos antibacterianos en la era de la genómica. Los fitoquímicos son el componente biológico activo de las plantas y algunos fitoquímicos que incluyen taninos, alcaloides, terpenoides y flavonoides poseen actividad antimicrobiana. Algunos suplementos dietéticos antioxidantes también contienen fitoquímicos (polifenoles), como el extracto de semilla de uva, y demuestran in vitro propiedades antibacterianas. Los fitoquímicos pueden inhibir la síntesis de peptidoglucano, dañar estructuras de membrana microbiana, modificar la hidrofobicidad de la superficie de la membrana bacteriana y también modular la detección de quórum. Con el aumento de la resistencia a los antibióticos en los últimos años, se está investigando el potencial de nuevos antibióticos derivados de plantas.
Nuevo desarrollo de antibióticos
Tanto la OMS como la Sociedad de Enfermedades Infecciosas de América (IDSA) informaron que la tubería débil de antibióticos no coincide con la creciente capacidad de las bacterias para desarrollar resistencia. El informe de IDSA señaló que la cantidad de nuevos antibióticos aprobados para su comercialización por año había ido disminuyendo e identificó siete antibióticos contra los bacilos Gram-negativos (GNB) actualmente en ensayos clínicos de fase 2 o fase 3. Sin embargo, estos medicamentos no abordaron todo el espectro de resistencia de GNB. Según la OMS, cincuenta y una nuevas entidades terapéuticas (NTE), antibióticos (incluidas combinaciones), se encuentran en ensayos clínicos de fase 1-3 a partir de mayo de 2017.
Las entradas recientes en la cartera clínica dirigida a patógenos Gram-positivos resistentes a múltiples fármacos han mejorado las opciones de tratamiento debido a la aprobación de comercialización de nuevas clases de antibióticos, las oxazolidinonas y los lipopéptidos cíclicos. Sin embargo, es probable que la resistencia a estos antibióticos ocurra, la necesidad de desarrollar nuevos antibióticos contra esos patógenos sigue siendo una alta prioridad. Los medicamentos recientes en desarrollo que se dirigen a bacterias Gram-negativas se han centrado en volver a trabajar los medicamentos existentes para atacar microorganismos específicos o tipos específicos de resistencia.
Algunos antibióticos han recibido autorización de comercialización en los últimos siete años. La cefalosporina ceftarolina y los lipoglucopéptidos oritavancina y telavancina para el tratamiento de la infección bacteriana aguda de la piel y de la estructura de la piel y la neumonía bacteriana adquirida en la comunidad. El lipoglycopeptide dalbavancin y el oxazolidinone tedizolid también han sido aprobados para su uso en el tratamiento de infecciones bacterianas agudas de la piel y de la estructura de la piel. El primero en una nueva clase de antibióticos macrocíclicos de espectro estrecho, la fidaxomicina, ha sido aprobado para el tratamiento de la colitis por C. difficile . Las nuevas combinaciones de inhibidores de cefalosporina-lactamasa también aprobados incluyen ceftazidima-avibactam y ceftolozano-avibactam para la infección complicada del tracto urinario y la infección intraabdominal.
- Ceftolozano / tazobactam (CXA-201; CXA-101 / tazobactam): combinación de antipseudomonalcephalosporin / inhibidor de β-lactamasa (inhibidor de la síntesis de la pared celular). Aprobado por la FDA el 19 de diciembre de 2014.
- Ceftazidima / avibactam (ceftazidima / NXL104): combinación de inhibidores antipseudomonales de cefalosporina / β-lactamasa (inhibidor de la síntesis de la pared celular). En la fase 3.
- Ceftaroline / avibactam (CPT-avibactam; ceftaroline / NXL104): combinación de anti-MRSAcephalosporin / β-lactamase inhibidor (inhibidor de la síntesis de la pared celular)
- Imipenem / MK-7655: combinación de inhibidores de carbapenem / β-lactamasa (inhibidor de la síntesis de la pared celular). En la fase 2.
- Plazomicina (ACHN-490): Aminoglucósido (inhibidor de la síntesis de proteínas). La solicitud de nuevos medicamentos está bajo revisión prioritaria por la FDA de EE. UU.
- Eravaciclina (TP-434): derivado sintético de la tetraciclina / inhibidor de la síntesis de proteínas dirigido al ribosoma. Desarrollo por Tetraphase, ensayos de Fase 2 completos.
- Brilacidina (PMX-30063): proteína peptídica de defensa mimética (disrupción de la membrana celular). En la fase 2.
Se espera que la investigación de Streptomyces brinde nuevos antibióticos, incluido el tratamiento contra el SARM y las infecciones resistentes a los medicamentos de uso común. Los esfuerzos del John Innes Center y las universidades en el Reino Unido, apoyados por BBSRC, dieron como resultado la creación de empresas spin-out, por ejemplo Novacta Biosystems, que diseñó el compuesto NVB302 basado en antibióticos tipo B (en fase 1) para tratar el Clostridium infecciones difficile .
Las posibles mejoras incluyen la aclaración de las regulaciones de ensayos clínicos por parte de la FDA. Además, los incentivos económicos apropiados podrían persuadir a las compañías farmacéuticas a invertir en este empeño. En los EE. UU., Se introdujo la Ley de desarrollo de antibióticos para avanzar en el tratamiento de pacientes (ADAPT) con el objetivo de rastrear rápidamente el desarrollo de antibióticos en medicamentos para combatir la creciente amenaza de "superbacterias". Según esta Ley, la FDA puede aprobar antibióticos y antifúngicos que tratan infecciones potencialmente mortales basadas en ensayos clínicos más pequeños. El CDC supervisará el uso de antibióticos y la resistencia emergente, y publicará los datos. El proceso de etiquetado de antibióticos de la FDA, "Criterios de interpretación de la prueba de susceptibilidad para organismos microbianos" o "puntos de corte", proporcionará datos precisos para los profesionales de la salud. De acuerdo con Allan Coukell,